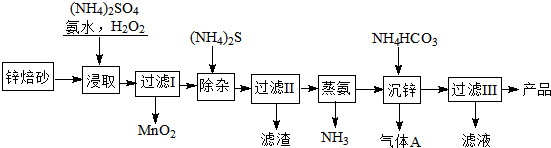
题目内容
13.已知3.0g乙烷完全燃烧在常温下放出的热量为155.98kJ,则下列关于乙烷燃烧热的热化学方程式书写正确的是( )| A. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3 119.6 kJ•mol-1 | |
| B. | C2H6(g)+$\frac{5}{2}$O2(g)═2CO(g)+3H2O(g)△H=-1 559.8 kJ•mol-1 | |
| C. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(g)△H=-1 559.8 kJ•mol-1 | |
| D. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1 559.8 kJ•mol-1 |
分析 燃烧热的热化学方程式中可燃物的物质的量为1mol,产物为稳定氧化物;依据3.0g乙烷完全燃烧在常温下放出的热量为155.98kJ,结合燃烧热的定义计算求出1mol乙烷完全燃烧放出的热量,然后写出乙烷燃烧热的热化学方程式.
解答 解:燃烧热是指:在25℃、101KPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量;
3.0g乙烷完全燃烧在常温下放出的热量为155.98kJ,则1mol乙烷,质量为30g,完全燃烧生成稳定的氧化物放出的热量为:$\frac{30g}{3.0g}$×155.98kJ=1559.8KJ,
则乙烷燃烧热的热化学方程式为:C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1559.8kJ/mol,
故选D.
点评 本题考查了燃烧热的概念以及燃烧热的热化学方程式的书写方法,题目难度不大,明确热化学方程式的书写原则为解答关键,注意燃烧热的热化学方程式中可燃物的物质的量为1mol,产物必须是稳定的氧化物,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
3.有关下列微粒的化学用语正确的是( )
| A. | CS2的电子式为: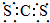 | |
| B. | Ca2+的离子结构示意图为: | |
| C. | HClO的结构式为:H-Cl-O | |
| D. | 质子数为35,中子数为46的核素的核素符号为:${\;}_{35}^{81}$Br |
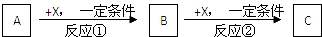
4.塑料抗氧化剂C可通过下列反应合成:

下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 物质A中所含碳原子可能在同一个平面内 | |
| B. | 物质A生成物质B是加成反应,物质B生成物质C是酯化反应 | |
| C. | 物质B具有酚羟基,但不能与浓溴水产生白色沉淀 | |
| D. | 1mol抗氧化剂C能与NaOH溶液反应,最多消耗3 molNaOH |
1.在铜与稀硝酸的反应中,如果有1mol的硝酸被还原,则被氧化的铜的物质的量为( )
| A. | 3 mol | B. | $\frac{3}{2}$mol | C. | $\frac{3}{8}$mol | D. | $\frac{8}{3}$mol |
18.H-H键的键能是436kJ•mol-1,I-I键的键能是151kJ•mol-1,H-I键的键能是299kJ•mol-1.则对反应H2(g)+I2(g)?2HI(g)的说法,不正确的是( )
| A. | 氧化还原反应 | B. | 放热反应 | C. | 化合反应 | D. | 吸热反应 |
2.下列实脸操作或由实验得出的结论,错误的是( )
| A. | 用蒸馏水湿润的试纸测某溶液的pH,一定会使结果偏低 | |
| B. | 可用酸式滴定管准确量取10.00mLKMnO4溶液 | |
| C. | 在中和热测定实验中,不能用温度计来搅拌溶液 | |
| D. | 将乙烯通入酸性高锰酸钾溶液,可检验乙烯的还原性 |
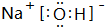 ;
;