题目内容
2.下列实脸操作或由实验得出的结论,错误的是( )| A. | 用蒸馏水湿润的试纸测某溶液的pH,一定会使结果偏低 | |
| B. | 可用酸式滴定管准确量取10.00mLKMnO4溶液 | |
| C. | 在中和热测定实验中,不能用温度计来搅拌溶液 | |
| D. | 将乙烯通入酸性高锰酸钾溶液,可检验乙烯的还原性 |
分析 A.用蒸馏水湿润的试纸测某溶液的pH,可能不影响结果;
B.酸式滴定管只能量取酸性溶液,且滴定管的感量是0.01mL;
C.在中和热测定实验中,应该用环形玻璃搅拌棒搅拌混合溶液;
D.乙烯中含有碳碳双键而能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色.
解答 解:A.用蒸馏水湿润的试纸测某溶液的pH,可能不影响结果,如强酸强碱盐溶液浓度与其pH无关,所以用蒸馏水湿润试纸测其pH不影响结果,故A错误;
B.酸式滴定管只能量取酸性溶液,且滴定管的感量是0.01mL,高锰酸钾溶液呈酸性,可以用酸式滴定管量取,且该测定结果的最小刻度是0.01mL,故B正确;
C.在中和热测定实验中,应该用环形玻璃搅拌棒搅拌混合溶液,不能用玻璃棒搅拌,否则易损坏玻璃棒,故C正确;
D.乙烯中含有碳碳双键而能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,该反应中酸性高锰酸钾作氧化剂、乙烯作还原剂,则乙烯体现还原性,故D正确;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及仪器选取、氧化还原反应、实验操作等知识点,明确实验原理、物质性质、仪器用途等知识点是解本题关键,易错选项是A,注意某些溶液浓度大小不影响pH,题目难度不大.

练习册系列答案
相关题目
12.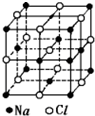 已知NaCl的摩尔质量为Mg.mol-1,NaCl晶体的密度为ρg.cm-3,图大正方体为NaCl晶体的最小重复单元(晶胞),其中顶点离子为8个晶胞所共有,晶胞中Na+与最邻近的Cl-的核间距离为a cm,则阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为Mg.mol-1,NaCl晶体的密度为ρg.cm-3,图大正方体为NaCl晶体的最小重复单元(晶胞),其中顶点离子为8个晶胞所共有,晶胞中Na+与最邻近的Cl-的核间距离为a cm,则阿伏加德罗常数的值可表示为( )
 已知NaCl的摩尔质量为Mg.mol-1,NaCl晶体的密度为ρg.cm-3,图大正方体为NaCl晶体的最小重复单元(晶胞),其中顶点离子为8个晶胞所共有,晶胞中Na+与最邻近的Cl-的核间距离为a cm,则阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为Mg.mol-1,NaCl晶体的密度为ρg.cm-3,图大正方体为NaCl晶体的最小重复单元(晶胞),其中顶点离子为8个晶胞所共有,晶胞中Na+与最邻近的Cl-的核间距离为a cm,则阿伏加德罗常数的值可表示为( )| A. | 2Ma3ρ | B. | $\frac{M}{{a}^{3}ρ}$ | C. | $\frac{2M}{{a}^{3}ρ}$ | D. | $\frac{M}{2{a}^{3}ρ}$ |
13.已知3.0g乙烷完全燃烧在常温下放出的热量为155.98kJ,则下列关于乙烷燃烧热的热化学方程式书写正确的是( )
| A. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3 119.6 kJ•mol-1 | |
| B. | C2H6(g)+$\frac{5}{2}$O2(g)═2CO(g)+3H2O(g)△H=-1 559.8 kJ•mol-1 | |
| C. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(g)△H=-1 559.8 kJ•mol-1 | |
| D. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1 559.8 kJ•mol-1 |
10.在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg•cm-3,(ρ<1)溶质的质量分数为ω,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
| A. | ω=$\frac{35a}{22.4Vρ}$×100% | |
| B. | c=$\frac{1000a}{22.4V}$ | |
| C. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω | |
| D. | 上述溶液中再加入1.5VmL同物质的量浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
17.X、Y、Z、W为原子序数依次增大的短周期元素,X、Y同主族,Z、W同周期.下列说法正确的是(m、n均为正整数)( )
| A. | 若Z(OH)n为强碱,则W(OH)m也一定为强碱 | |
| B. | 若HnXOm为强酸,则Z的气态氢化物溶于水一定显酸性 | |
| C. | Z可以从W的盐溶液中将W置换出来 | |
| D. | 若Z的最高正价为+3价,则W的氢化物水溶液一定显碱性 |
14.含有一个叁键的炔烃,氢化后结构式为 ,此炔烃可能有的结构简式有( )
,此炔烃可能有的结构简式有( )
 ,此炔烃可能有的结构简式有( )
,此炔烃可能有的结构简式有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
 A是在人们日常生活中最常见的有机物,75%(体积分数)的水溶液可用于医疗消毒,B是一种植物生长调节剂,通常情况下C是一种具有果香味的无色液体.
A是在人们日常生活中最常见的有机物,75%(体积分数)的水溶液可用于医疗消毒,B是一种植物生长调节剂,通常情况下C是一种具有果香味的无色液体.