题目内容
12.已知阿伏伽德罗常数可表示为NA,则下列说法正确的是( )| A. | 任何气体单质在标准状况下体积约为22.4L,则一定含有2NA个原子 | |
| B. | 常温常压下,22g氧气和26g臭氧所含氧原子总数为3NA | |
| C. | 常温常压下,22.4LH2O中含有的氢原子数为2NA | |
| D. | 标准状况下,0.3molCO2中含有氧原子数0.3NA |
分析 A.气体单质可能是单原子分子、双原子分子、多原子分子;
B.氧气和臭氧都由氧原子构成;
C.常温常压下,22.4LH2O的物质的量不是1mol;
D.每个二氧化碳分子中含有2个氧原子.
解答 解:A.任何气体单质在标准状况下体积约为22.4L,都含有NA个分子,但是单质分子构成不尽相同,因此所含原子数也就不尽相同,故A错误;
B.22g氧气和26g臭氧中所含氧原子的物质的量为$\frac{22g+26g}{16g/mol}$=3mol,氧原子总数为3NA,故B正确;
C.常温常压下,22.4LH2O的物质的量不是1mol,因此所含氢原子数不是2NA,故C错误;
D.每个二氧化碳分子中含有2个氧原子,因此0.3molCO2中含有氧原子数0.6NA,故D错误;
故选B.
点评 本题考查阿伏伽德罗常数,涉及物质的组成和以物质的量为中心的公式的综合应用,为高考热点,题目难度不大,注意公式的使用前提,灵活应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.三氯化硼(BCl3)是一种重要的化工原料.某兴趣小组拟选用下列装置(装置可重复使用),用氯气和硼制备BCl3(已知BCl3的沸点为12.5℃,熔点为-107.3℃;遇水剧烈反应生成硼酸和盐酸).

(1)装置A中反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)上述装置连接顺序为AACFBDECACFBDEF.
(3)装置A中a管的作用是导气.装置B中饱和食盐水的作用吸收氯气中的氯化氢气体.
(4)已知:硼酸(H3BO3)是一元弱酸,其钠盐化学式为Na[B(OH)4],则硼酸在水中的电离方程式是H3BO3+H2O?[B(OH)4]-+H+.
(5)实验完成后,该小组同学向F中(溶液含有NaClO、NaCl、NaOH)滴加品红溶液,发现溶液褪色,现设计对照实验探究溶液褪色的影响因素.
表格中b值为2.0,通过实验得出的结论是氯化钠浓度越大、溶液碱性越强次氯酸钠漂白性越弱.

(1)装置A中反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)上述装置连接顺序为AACFBDECACFBDEF.
(3)装置A中a管的作用是导气.装置B中饱和食盐水的作用吸收氯气中的氯化氢气体.
(4)已知:硼酸(H3BO3)是一元弱酸,其钠盐化学式为Na[B(OH)4],则硼酸在水中的电离方程式是H3BO3+H2O?[B(OH)4]-+H+.
(5)实验完成后,该小组同学向F中(溶液含有NaClO、NaCl、NaOH)滴加品红溶液,发现溶液褪色,现设计对照实验探究溶液褪色的影响因素.
| 实验序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.mol/LNaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
| Ⅰ | 4.0 | 2.0 | 0 | 2.0 | 3滴 | 较快褪色 |
| Ⅱ | 4.0 | 4.0 | 0 | 0 | 3滴 | 缓慢褪色 |
| Ⅲ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
| Ⅳ | 4.0 | 0 | 2.0 | b | 3滴 | 较快褪色 |
20.NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 | |
| B. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% | |
| C. | 一定温度下,1molFeCl3水解生成NA个Fe(OH)3胶体颗粒 | |
| D. | 在标准状况下,2.24L苯中所含分子数约为NA |
4.某烃结构式如图: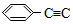 -CH=CH-CH3,有关其结构说法正确的是( )
-CH=CH-CH3,有关其结构说法正确的是( )
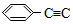 -CH=CH-CH3,有关其结构说法正确的是( )
-CH=CH-CH3,有关其结构说法正确的是( )| A. | 所有原子可能在同一平面上 | B. | 侧链所有碳原子可能共直线 | ||
| C. | 所有碳原子可能共面 | D. | 最多有18原子共面 |
2.下列说法不正确的是( )

| A. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10,碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中不可能观察到有气泡产生 | |
| B. | 25℃时,将amol•L氨水与0.01mol•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(CI-),用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示.II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b | |
| D. | 向0.10mol•L-1NaHSO4溶液中通入NH3至溶液pH=7(通入气体对溶液体积的影响可忽略):c(Na+)>c(SO42-)>c(NH4+) |
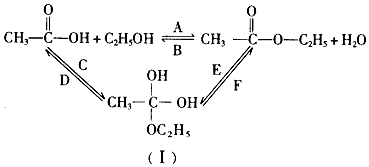
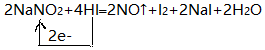 .
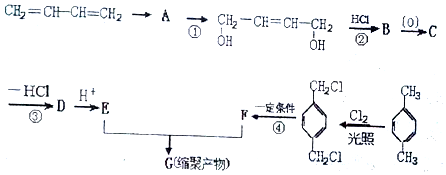
.
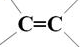 、-COOH.
、-COOH. .
.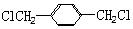 的同分异构体中含有苯环,且苯环上有三个取代基的同分异构体有16种.
的同分异构体中含有苯环,且苯环上有三个取代基的同分异构体有16种.