题目内容
11.常温下用pH=3的某酸溶液分别与pH=11的氢氧化钠溶液等体积混合,关于所得溶液酸碱性说法正确的是( )| A. | 不可能显碱性 | B. | 不可能显中性 | ||
| C. | 不可能显酸性 | D. | 可能中性、碱性、酸性 |
分析 若酸为强酸,则和pH=11的氢氧化钠溶液恰好完全反应,生成强酸强碱盐;
若酸为弱酸,则酸过量,得到的是过量和酸和生成的强碱弱酸盐的混合溶液,根据电离大于水解来分析.
解答 解:pH=3的某酸溶液中,氢离子的浓度为10-3mol/L,pH=11的氢氧化钠溶液中,氢氧根的浓度为10-3mol/L.
若酸为强酸,则pH=3的强酸和pH=11的氢氧化钠溶液等体积混合时恰好完全反应,生成强酸强碱盐,故溶液显中性;
若酸为弱酸,则酸没有完全电离,故酸过量,得到的溶液是过量和酸和生成的强碱弱酸盐的混合溶液,由于酸的电离程度通常大于盐的水解程度,故溶液显酸性.
综上分析可知,所得的溶液可能显中性也可能显酸性,但不能显碱性,故选A.
点评 本题考查了酸碱混合后溶液的酸碱性的分析,应注意根据酸的强弱来讨论,难度不大,应注意的是一般情况下,没有特殊说明时,认为酸的电离程度大于盐的水解程度.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
1.用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:
Pb+PbO2+4HBF4$?_{放电}^{充电}$2Pb(BF4)2+2H2O;
Pb(BF4)2为可溶于水的强电解质,下列说法正确的是( )
Pb+PbO2+4HBF4$?_{放电}^{充电}$2Pb(BF4)2+2H2O;
Pb(BF4)2为可溶于水的强电解质,下列说法正确的是( )
| A. | 放电时的负极反应为:PbO2+4H++2e-=Pb2++2H2O | |
| B. | 充电时,当阳极质量增加23.9 g时,溶液中有0.2 mol电子通过 | |
| C. | 放电时,正极区pH增大 | |
| D. | 充电时,Pb电极与电源的正极相连 |
19.关节炎的成因是在关节滑液中形成尿酸钠晶体-NaUr,其平衡关系为:Ur-(aq)+Na+(aq)?NaUr(s),其中Ur-表示尿酸根离子.医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位.因为第一次关节炎的发作大都在手指或脚趾的关节处.这说明( )
| A. | 形成尿酸钠晶体的反应为放热反应 | B. | 形成尿酸钠晶体的反应为吸热反应 | ||
| C. | 尿酸钠溶液呈酸性 | D. | 尿酸钠晶体一定难溶于水 |
16.下列实验对应的结论正确的是( )
| A. | 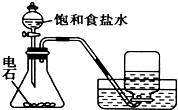 实验室制取乙炔 | B. | 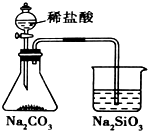 能证明非金属性Cl>C>Si | ||
| C. | 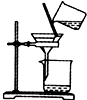 分离出Cl2与KI溶液反应生成的碘 | D. | 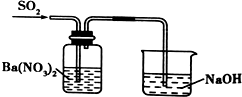 洗气瓶中产生白色沉淀 |
10.若向含Na+、AlO2-、SiO32?、CO32-、OH-的溶液中逐滴加入盐酸,得到沉淀的物质的量与盐酸物质的量的
关系如图所示,则该下列说法正确的是( )
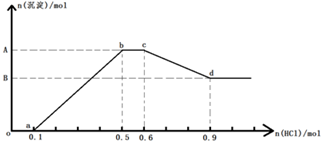
关系如图所示,则该下列说法正确的是( )

| A. | 原溶液中n(Na+)=0.6mol | B. | 原溶液中n(AlO2-)=0.3mol | ||
| C. | A点对应的沉淀物质的量为0.2mol | D. | bc段的反应为:CO32-+H+=HCO3- |
11.A、B、C、D、E、F为前四周期的六种元素,原子序数依次增大,其相关信息如下:
请回答下列问题:
(1)F位于元素周期表第ⅠB族,其简化电子排布式为[Ar]3d104s1.
(2)D元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断E基态原子的核外电子排布图为: ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.
(4)A与D形成的D2A4分子中D原子的杂化类型为sp3杂化,A与D形成的最简单分子易溶于水的原因氨气分子能与水分子形成氢键.
(5)C的一种单质相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环(如图1).则1个这种单质分子中所含π键的数目为30.
(6)已知在元素周期表中存在“对角线规则”,即周期表中左上方与右下方元素它们的单质及其化合物性质相似,如Li和Mg,试写出DCl2溶液中加入过量的NaOH溶液反应的化学方程式:BeCl2+4NaOH═Na2BeO2+2NaCl+2H2O.
(7)图2是金属Ca和F所形成的某种合金的晶胞结构示意图,已知铜镍合金与上述合金具有相同类型的晶胞结构XYa,它们有很强的储氢能力.已知铜镍合金LaNin晶胞体积为9.0×10-33cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=5(填数值);氢在合金中的密度为0.083g•cm-3.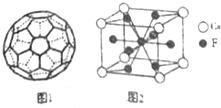
| 相关信息 | |
| A | 所处的周期数、族序数分别与其原子序数相等 |
| B | 原子核外电子有4种不同的运动状态 |
| C | 元素原子的核外成对电子数是未成对电子数的2倍且有3个能级 |
| D | 元素原子的核外p电子数比s电子数少1 |
| E | E原子的第一至第四电离能如下: I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| F | 第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满 |
(1)F位于元素周期表第ⅠB族,其简化电子排布式为[Ar]3d104s1.
(2)D元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断E基态原子的核外电子排布图为:
 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.(4)A与D形成的D2A4分子中D原子的杂化类型为sp3杂化,A与D形成的最简单分子易溶于水的原因氨气分子能与水分子形成氢键.
(5)C的一种单质相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环(如图1).则1个这种单质分子中所含π键的数目为30.
(6)已知在元素周期表中存在“对角线规则”,即周期表中左上方与右下方元素它们的单质及其化合物性质相似,如Li和Mg,试写出DCl2溶液中加入过量的NaOH溶液反应的化学方程式:BeCl2+4NaOH═Na2BeO2+2NaCl+2H2O.
(7)图2是金属Ca和F所形成的某种合金的晶胞结构示意图,已知铜镍合金与上述合金具有相同类型的晶胞结构XYa,它们有很强的储氢能力.已知铜镍合金LaNin晶胞体积为9.0×10-33cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=5(填数值);氢在合金中的密度为0.083g•cm-3.

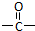 ”相连的碳原子上的氢活性较大,可以与甲醛或卤代烃等发生反应.
”相连的碳原子上的氢活性较大,可以与甲醛或卤代烃等发生反应.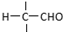 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$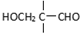
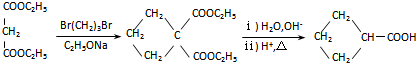
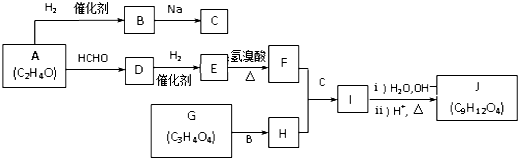
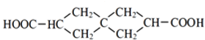 .J的同分异构体X属于芳香族化合物,1mol X分别与足量Na或NaOH反应时的物质的量之比是1:4和1:1,且苯环上只有一种一氯代物.写出符合上述所有条件的X的一种结构简式
.J的同分异构体X属于芳香族化合物,1mol X分别与足量Na或NaOH反应时的物质的量之比是1:4和1:1,且苯环上只有一种一氯代物.写出符合上述所有条件的X的一种结构简式 .
.