题目内容
10.若向含Na+、AlO2-、SiO32?、CO32-、OH-的溶液中逐滴加入盐酸,得到沉淀的物质的量与盐酸物质的量的关系如图所示,则该下列说法正确的是( )
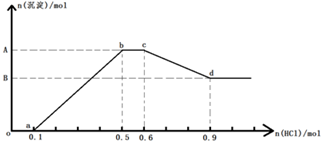
| A. | 原溶液中n(Na+)=0.6mol | B. | 原溶液中n(AlO2-)=0.3mol | ||
| C. | A点对应的沉淀物质的量为0.2mol | D. | bc段的反应为:CO32-+H+=HCO3- |
分析 向含Na+、AlO2-、SiO32?、CO32-、OH-的溶液中逐滴加入盐酸,
o-a段无沉淀生成,是氢离子与氢氧根反应,消耗氢离子的物质的量为0.1mol,则n(OH-)=0.1mol;
a-b段是AlO2-、SiO32?与氢离子反应生成氢氧化铝沉淀、硅酸沉淀,共消耗氢离子0.4mol;
b-c段是CO32-与盐酸的反应,反应的离子方程式为:H++CO32-=HCO3-,H++HCO3-═CO2↑+H2O,总反应为CO32-+2H+=CO2↑+H2O,消耗氢离子0.1mol,则n(CO32-)=0.05mol;
c-d段是氢氧化铝沉淀溶解过程,Al(OH)3~3H+,氢离子消耗0.3mol,则Al(OH)3的物质的量为0.1mol,根据原子守恒可知溶液中的n(AlO2-)=0.1mol;
a-b段AlO2-+H++H2O=Al(OH)3↓,所以AlO2-消耗氢离子0.1mol,a-b段SiO32?消耗氢离子0.4mol-0.1mol=0.3mol,根据SiO32?+2H+=H2SiO3↓,则n(SiO32?)=0.15mol.
解答 解:向含Na+、AlO2-、SiO32?、CO32-、OH-的溶液中逐滴加入盐酸,
o-a段无沉淀生成,是氢离子与氢氧根反应,消耗氢离子的物质的量为0.1mol,则n(OH-)=0.1mol;
a-b段是AlO2-、SiO32?与氢离子反应生成氢氧化铝沉淀、硅酸沉淀,共消耗氢离子0.4mol;
b-c段是CO32-与盐酸的反应,反应的离子方程式为:H++CO32-=HCO3-,H++HCO3-═CO2↑+H2O,总反应为CO32-+2H+=CO2↑+H2O,消耗氢离子0.1mol,则n(CO32-)=0.05mol;
c-d段是氢氧化铝沉淀溶解过程,Al(OH)3~3H+,氢离子消耗0.3mol,则Al(OH)3的物质的量为0.1mol,根据原子守恒可知溶液中的n(AlO2-)=0.1mol;
a-b段AlO2-+H++H2O=Al(OH)3↓,所以AlO2-消耗氢离子0.1mol,a-b段SiO32?消耗氢离子0.4mol-0.1mol=0.3mol,根据SiO32?+2H+=H2SiO3↓,则n(SiO32?)=0.15mol.
综上所述,n(OH-)=0.1mol,n(CO32-)=0.05mol,n(AlO2-)=0.1mol,n(SiO32?)=0.15mol,
A.n(OH-)=0.1mol,n(CO32-)=0.05mol,n(AlO2-)=0.1mol,n(SiO32?)=0.15mol,负电荷的物质的量为:0.1mol+0.05mol×2+0.1mol+0.15mol×2=0.6mol,根据电荷守恒可知原溶液中n(Na+)=0.6mol,故A正确;
B.原溶液中n(AlO2-)=0.1mol,故B错误;
C.a-b段发生反应:AlO2-+H++H2O=Al(OH)3↓,SiO32?+2H+=H2SiO3↓,A点对应的沉淀是Al(OH)3、H2SiO3,它们的物质的量分别为0.1mol、0.15mol,共0.25mol,故C错误;
D.bc段的反应为:H++CO32-=HCO3-,H++HCO3-═CO2↑+H2O,总反应为CO32-+2H+=CO2↑+H2O,故D错误;
故选:A.
点评 本题考查了离子反应的计算,明确图象曲线变化的含义为解答关键,注意掌握常见离子的性质,试题培养了学生的分析能力及灵活应用的能力.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| A. | 含11个质子、12个中子、10个电子的粒子 | |
| B. | 含18个质子、22个中子、18个电子的粒子 | |
| C. | 含17个质子、18个中子、17个电子的粒子 | |
| D. | 含17个质子、20个中子、18个电子的粒子 |
| A. | 不可能显碱性 | B. | 不可能显中性 | ||
| C. | 不可能显酸性 | D. | 可能中性、碱性、酸性 |
| A. | 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 | |
| B. | 麦芽糖和蔗糖互为同分异构体 | |
| C. | 淀粉遇碘化钾溶液变蓝 | |
| D. | 糖类不一定都能水解 |
| A. | CH3-CH=CH2和CH2=CH2的最简式相同 | |
| B. | 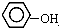 与 与 互为同系物 互为同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小 |
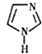 离子液体在有机合成、无机合成等方面有着重要应用.咪唑是合成“离子液体”的一种原料,其结构如图所示,下列有关咪唑说法正确的是( )
离子液体在有机合成、无机合成等方面有着重要应用.咪唑是合成“离子液体”的一种原料,其结构如图所示,下列有关咪唑说法正确的是( )| A. | 分子式为C3H3N2 | |
| B. | 分子中含有一种非极性键和两种极性键 | |
| C. | 可以发生取代、加成、氧化反应 | |
| D. | 一氯取代物的同分异构体共有5种 |
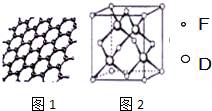 原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,C与D同主族相邻;E的最外层只有1个电子,但次外层有18个电子;F位于周期表的ds区,最外层有2个电子.
原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,C与D同主族相邻;E的最外层只有1个电子,但次外层有18个电子;F位于周期表的ds区,最外层有2个电子. 图是部分主族元素第一电离能梯度图,图中a点对应的元素为氢,b、c两点对应的元素分别为O、Si(填元素符号).
图是部分主族元素第一电离能梯度图,图中a点对应的元素为氢,b、c两点对应的元素分别为O、Si(填元素符号).