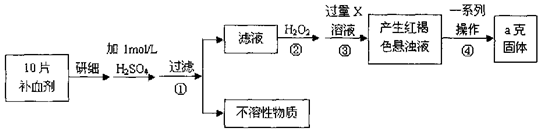
题目内容
2.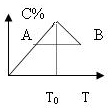 对于反应2A+B?2C的反应过程中C的百分含量随温度的变化如图所示,则:
对于反应2A+B?2C的反应过程中C的百分含量随温度的变化如图所示,则:(1)T0对应的υ正与υ逆的关系是v正=v逆.
(2)正反应为放 热反应.
(3)A、B两点正反应速率大小关系是vA<vB.
分析 (1)由图可知,温度T0前,C的质量分数增大,故未达平衡,反应向正反应进行,温度T0后,C的质量分数减小,平衡向逆反应进行,故温度T0时,反应到达平衡状态;
(2)温度升高平衡向逆反应移动,故正反应为放热反应;
(3)A、B两点,各组分的浓度相同,温度越高反应速率与快.
解答 解:(1)由图可知,温度T0前,C的质量分数增大,故未达平衡,反应向正反应进行,温度T0后,C的质量分数减小,平衡向逆反应进行,故温度T0时,反应到达平衡状态,故v正=v逆,
故答案为:v正=v逆;
(2)温度升高平衡向逆反应移动,故正反应为放热反应,
故答案为:放;
(3)A、B两点,各组分的浓度相同,温度越高反应速率越快,故VA<VB,
故答案为:vA<vB.
点评 本题考查化学平衡图象、影响化学平衡的因素等,为高频考点,侧重于学生的分析能力的考查,难度中等,注意根据C的质量分数判断温度T0前未达平衡,从T0后为平衡状态.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
20.在密闭容器中进行反应:X(g)+3Y(g)?2Z(g),下列说法正确的是( )
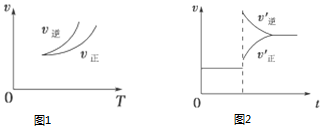

| A. | 图1说明正反应为吸热反应 | |
| B. | 反应达平衡后,增大压强气体密度将减小 | |
| C. | 图2可表示升高温度使平衡向逆反应方向移动 | |
| D. | 图2虚线可表示使用催化剂后引发的反应速率变化 |
13.今年,雾霾阴影笼罩全国.二氧化硫、氮氧化物和可吸入颗粒物是雾霾的主要组成成分,综合治理其污染是环境化学当前的重要研究内容.
(1)汽车尾气中的 NO(g)和CO(g)在一定温度和催化剂的条件下可净化.发生的反应如下:2NO(g)+2CO(g)═2CO2 (g)+N2(g)
①已知:N2(g)+O2 (g)═2NO(g)△H=+180.0kJ/mol.部分化学键的键能如下(键能指气态原子形成1mol化学键释放的最小能量)
则反应:2NO(g)+2CO(g)═2CO2 (g)+N2 (g)△H=-751.0 kJ/mol
②若上述反应在绝热、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图1不符合题意的是C(填选项序号).(图中ω、M、v正 分别表示质量分数、混合气体平均相对分子质量、正反应速率)

(2)尾气中的SO2可先催化氧化生成SO3,再合成硫酸.已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.0kJ/mol.
①在一定温度的密闭容器中,SO2的转化率随时间的变化关系如图2所示:
则A点的v逆(SO2 )小于(填大于、小于或等于)B点的 v正(SO2).
②在某温度时,向10L的密闭容器中加入4.0molSO2和10.0molO2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是BC(填选项序号).
A.在其他条件不变时,减小容器的容积
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)利用电化学原理,将NO2、O2和熔融KNO3 制成燃料电池,其原理如图3所示.
该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用.石墨Ⅱ是电池的正极,石墨Ⅰ附近发生的电极反应式为NO2+NO3--e-=N2O5.相同条件下,消耗的O2和NO2的体积比为1:4.
(4)尾气中氮氧化物(NO和NO2)也可用尿素[CO(NH2)2]溶液除去,反应生成对大气无污染的气体.1mol 尿素能吸收工业尾气中氮氧化物(假设 NO、NO2体积比为 1:1)的质量为76g.
(1)汽车尾气中的 NO(g)和CO(g)在一定温度和催化剂的条件下可净化.发生的反应如下:2NO(g)+2CO(g)═2CO2 (g)+N2(g)
①已知:N2(g)+O2 (g)═2NO(g)△H=+180.0kJ/mol.部分化学键的键能如下(键能指气态原子形成1mol化学键释放的最小能量)
| 化学键 | O═O | C≡O | C═O |
| 键能(kJ/mol) | 497 | 1072 | 803 |
②若上述反应在绝热、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图1不符合题意的是C(填选项序号).(图中ω、M、v正 分别表示质量分数、混合气体平均相对分子质量、正反应速率)

(2)尾气中的SO2可先催化氧化生成SO3,再合成硫酸.已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.0kJ/mol.
①在一定温度的密闭容器中,SO2的转化率随时间的变化关系如图2所示:
则A点的v逆(SO2 )小于(填大于、小于或等于)B点的 v正(SO2).
②在某温度时,向10L的密闭容器中加入4.0molSO2和10.0molO2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是BC(填选项序号).
A.在其他条件不变时,减小容器的容积
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)利用电化学原理,将NO2、O2和熔融KNO3 制成燃料电池,其原理如图3所示.
该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用.石墨Ⅱ是电池的正极,石墨Ⅰ附近发生的电极反应式为NO2+NO3--e-=N2O5.相同条件下,消耗的O2和NO2的体积比为1:4.
(4)尾气中氮氧化物(NO和NO2)也可用尿素[CO(NH2)2]溶液除去,反应生成对大气无污染的气体.1mol 尿素能吸收工业尾气中氮氧化物(假设 NO、NO2体积比为 1:1)的质量为76g.
7.某实验需要95mL1mol/L的稀硫酸溶液,现用98%的浓硫酸(密度为1.84g/cm3)进行配置,该实验中,按使用仪器先后顺序排列正确的是( )
①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100m容量瓶⑥95mL容量瓶 ⑦胶头滴管 ⑧玻璃棒.
①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100m容量瓶⑥95mL容量瓶 ⑦胶头滴管 ⑧玻璃棒.
| A. | ②③⑧⑤⑦ | B. | ③②⑧①⑤⑦ | C. | ④⑤⑧⑥⑦① | D. | ①③⑧⑤⑦ |
11.下列性质的比较中正确的是( )
| A. | 原子半径:Cl>Na>O>N | B. | 碱性:NaOH<Mg(OH)2<Al(OH)3 | ||
| C. | 熔点:CBr4>CCl4>CF4 | D. | 热稳定性:HF>HCl>H2S>H2O |
12.N2O既是医学上的一种麻醉剂,又是一种常见的温室气体.制取N2O的方法有很多,例如①NH4NO3═N2O↑+2H2O②K2SO3+2NO═K2SO4+N2O↑③2NH3+2O2═N2O↑+3H2O ④2NaNO3+(NH4)2SO4═2N2O↑+Na2SO4+4H2O等.下列说法正确的是( )
| A. | 反应①中硝酸铵既是氧化剂又是还原剂,H2O是氧化产物 | |
| B. | 反应②中K2SO3是还原剂,N2O是氧化产物 | |
| C. | 反应③中每生成1 mol N2O,转移8 mol电子 | |
| D. | 反应④中NaNO3是还原剂,N2O既是氧化产物又是还原产物 |