题目内容
8.氰化钠(NaCN)是重要的化工原料,常用于化学合成、冶金工业等.回答下列问题:(1)可用纯碱、焦炭、氨气反应制取 NaCN,同时还有水生成,写出反应的化学方程式,并标明电子转移的方向和数目
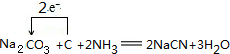 ;
;(2)现代采金技术先以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到 Na(二氰合金酸钠)溶液,再用锌还原 Na生成金,“浸取”反应的还原产物是NaOH;
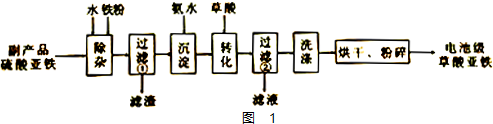
(3)如图1为用含NaCN的废水合成黄血盐(K4Fe(CN)6)的主要工艺流程如图:

已知相同温度下溶解度:Na4Fe(CN)6>K4Fe(CN)6
①实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.
②在转化罐中发生反应的化学方程式为Na4[Fe(CN)6+4KCl=4NaCl+K4[Fe(CN)6↓.
③加入碳酸钠溶液主要目的是除去过量的Ca2+.
④“操作”环节具体为过滤、洗涤、干燥.
(4)CN -可以造成水体污染,某小组用如下方法对此污水进行处理如图2装置模拟电化学法处理CN -,有关结果如表.
| 实验序号 | 电极(X) | NaCl溶液浓度(mol/L) | 甲中石墨表面通人气体 | 电流计读数(A) |
| (1) | Fe | 0.l | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5Ⅰ |
| (3) | Fe | 0.1 | 02 | 2Ⅰ |
| (4) | Al | 0.5 | 空气 | 1.6Ⅰ |
②该实验表明电化学法处理CN-时,影响处理速率的因素有负极的金属材料、甲中电解质氯化钠的浓度以及氧气的浓度(任答两点)
分析 (1)根据元素守恒可知,纯碱、焦炭、氨气反应制取 NaCN,同时会生成水,根据化合价的变化确定电子转化方向和数目;
(2)以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到 Na[Au(CN)2](二氰合金酸钠)溶液,再用锌还原 Na[Au(CN)2]生成金,根据元素的化合价的变化可知,NaCN中各元素的化合价没有变,是空气中的氧气氧化了金;
(3)本实验目的是合成黄血盐,由流程可知,NaCN废液中加入硫酸亚铁、氯化钙,发生6NaCN+FeSO4+CaCl2=Na4[Fe(CN)6+CaSO4↓+2NaCl,然后加入碳酸钠溶液可除去过量的Ca2+,经过滤后在滤液中加入KCl可转化生成K4[Fe(CN)6]说明K4[Fe(CN)6溶解度较小,过滤、洗涤、干燥得到K4[Fe(CN)6,
①NaCN为强碱弱酸盐,溶液中CN-离子水解溶液呈碱性,在配制溶液时抑制水解;
②在转化罐中加入KCl,Na4[Fe(CN)6可转化生成K4[Fe(CN)6];
③反应器中加入氯化钙过量,需要加入碳酸钠除去;
④转化罐中的反应是Na4[Fe(CN)6可转化生成K4[Fe(CN)6],K4[Fe(CN)6溶解度较小,过滤、洗涤、干燥得到K4[Fe(CN)6;
(4)①装置中阳极是发生氧化反应生成无毒无害的氮气和碳酸根离子;
②通过比较负极的金属材料和甲中电解质的浓度进行分析答题.
解答 解:(1)根据元素守恒可知,纯碱、焦炭、氨气反应制取 NaCN,同时会生成水,反应的化学方程式,并用单线桥标明电子转移的方向和数目为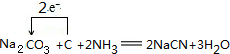 ,
,
故答案为: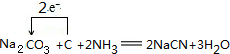 ;
;
(2)根据题意可知,NaCN溶液与Au以及空气中的氧气反应,Na[Au(CN)2]( 二氰合金酸钠)溶液,反应的化学方程式为4Au+8NaCN+2H2 O+O2=4Na[Au(CN)2]+4NaOH,所以氧化剂是氧气,还原产物为NaOH,
故答案为:NaOH;
(3)①NaCN为强碱弱酸盐,溶液中CN-离子水解溶液呈碱性,NaCN水解呈碱性的离子方程式为CN-+H2O?HCN+OH-,为抑制水解,在配制溶液时可将其溶解在氢氧化钠溶液中,在加水稀释,
故答案为:NaOH;
②在转化罐中加入KCl,Na4[Fe(CN)6可转化生成K4[Fe(CN)6],反应的化学方程式为Na4[Fe(CN)6+4KCl=4NaCl+K4[Fe(CN)6↓,
故答案为:Na4[Fe(CN)6+4KCl=4NaCl+K4[Fe(CN)6↓;
③反应器中加入氯化钙,加入碳酸钠溶液可除去过量的Ca2+,
故答案为:除去其中的Ca2+;
④转化罐中的反应是Na4[Fe(CN)6可转化生成K4[Fe(CN)6],K4[Fe(CN)6溶解度较小,过滤、洗涤、干燥得到K4[Fe(CN)6,
故答案为:过滤、洗涤、干燥;
(4)①乙装置中阳极是发生氧化反应生成无毒无害的氮气和碳酸根离子,电极反应式为2CN-+12OH--10e-=2CO32-+N2+6H2O,
故答案为:2CN-+12OH--10e-=2CO32-+N2+6H2O;
②通过比较表中的数据可知,影响处理速率的因素有负极的金属材料、电解质的浓度以及氧气的浓度,
故答案为:负极的金属材料;甲中电解质氯化钠的浓度以及氧气的浓度.
点评 本题考查物质的制备实验方案的设计,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型,注意根据流程图把握实验的原理和操作方法,难度中等,注意电解原理的分析、氧化还原反应的化合价的升降总数相等的计算等.

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案| A. | X元素可以组成多种单质 | |
| B. | Y和Z可能在同一周期 | |
| C. | X与W形成的化合物和Z与W形成的化合物的化学键类型不同 | |
| D. | 元素X、Y、W的最高价氧化物对应水化物的酸性强弱:X<Y<W |
| A. | 举行“地球一小时”熄灯活动 | B. | 露天焚烧稻草和秸秆 | ||
| C. | 夏天将空调的温度设置在26℃以上 | D. | 生活垃圾分类回收处理 |
| A. | 溴乙烷和氢氧化钠溶液混合共热 | |
| B. | 一氯甲烷和苛性钠的乙醇溶液混合共热 | |
| C. | 氯苯与氢氧化钠溶液混合共热 | |
| D. | 1-溴丁烷与氢氧化钾的乙醇溶液混合共热 |