题目内容
20.电池级草酸亚铁广泛用于新型电池材料等领域.利用制钛白粉的副产品硫酸亚铁(主要成分FeSO4•7H2O,含Al3+、Fe3+、TiO2+等杂质)生产电池级草酸亚铁的一种工艺流程如图1.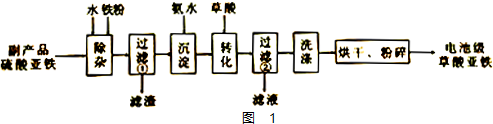
已知:①25℃时,草酸的电离平衡常数为:Ka1=5.9×10-2,Ka2=6.4×10-5.
②文献记载:草酸亚铁在中性或碱性环境中是不稳定的.
③几种难溶物的溶解度与pH的关系如图2所示.
回答下列问题:
(1)“除杂”步骤加入铁粉的作用有二:其一是还原Fe3+,其二是调节溶液的PH值;为除尽杂质,须控制pH至少5为宜,写出pH=3时除去杂质的反应离子方程式:TiO2++2H2O═H2TiO3↓+2H+.
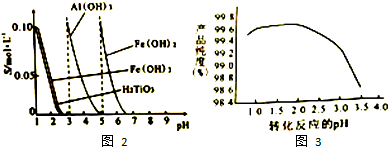
(2)“转化”步骤中草酸与 Fe(OH)2悬浊液的反应体系须控制条件.实验表明:酸度对产品纯度的影响如图3.随着pH的升高,导致产品纯度下降所发生的氧化还原反应方程式为4Fe(OH)2+2H2O+O2═4Fe(OH)3;为保证产品纯度大于99.5%,反应体系必须保持较低的pH,但过高的酸度又会使产品纯度降低,其原因是溶液的PH值太小会导致氢氧化亚铁溶解.
(3)“过滤②”步骤所得的滤液中含有的阳离子有NH4+、Fe3+、H+;此外,其中还含有一定量的H2C2O4,若该滤液的pH=2,则其中c(C2O42- ):c(H2C2O4 )=3.8×10-2.
(4)在“洗涤”步骤中,确认沉淀已洗涤干净的依据是取少量最一次洗涤滤液于试管中,加入足量的氯化钡溶液,没有出现白色浑浊.
分析 副产品硫酸亚铁(主要成分FeSO4•7H2O,含Al3+、Fe3+、TiO2+等杂质),加水和铁屑,Fe与Fe3+反应生成FeSO4,调节溶液的PH值为3左右时,TiO2+水解生成TiO2•xH2O,使铝离子水解生成氢氧化铝沉淀,过滤,滤渣为TiO2•xH2O、Fe、氢氧化铝,滤液中再加氨水生成氢氧化亚铁悬浊液,再加入草酸生成草酸亚铁沉淀,过滤得滤液为硫酸亚铁、硫酸铵等,滤渣为草酸亚铁,将草酸亚铁固体洗涤、干燥、粉碎即可得电池级草酸亚铁,
(1)样品中的杂质主要为Al3+、Fe3+、TiO2+等,加入铁粉可以还原铁离子,调节溶液的PH值使Al3+、TiO2+都水解产生沉淀而除去,据此答题;
(2)随着pH的升高,氢氧化亚铁容易被空气中氧气氧化为氢氧化铁,但溶液的PH值太小会导致氢氧化亚铁溶解,所以要保持合适的PH值;
(3)“过滤②”步骤所得的滤液为硫酸亚铁、硫酸铵等,据此判断阳离子,此外其中还含有一定量的H2C2O4,存在平衡H2C2O4?C2O42-+2H+,且K=Ka1•Ka2,据此计算c(C2O42- ):c(H2C2O4 );
(4)在“洗涤”步骤中,确认沉淀已洗涤干净可以根据洗涤液中是否含有硫酸根离子判断.
解答 解:副产品硫酸亚铁(主要成分FeSO4•7H2O,含Al3+、Fe3+、TiO2+等杂质),加水和铁屑,Fe与Fe3+反应生成FeSO4,调节溶液的PH值为3左右时,TiO2+水解生成TiO2•xH2O,使铝离子水解生成氢氧化铝沉淀,过滤,滤渣为TiO2•xH2O、Fe、氢氧化铝,滤液中再加氨水生成氢氧化亚铁悬浊液,再加入草酸生成草酸亚铁沉淀,过滤得滤液为硫酸亚铁、硫酸铵等,滤渣为草酸亚铁,将草酸亚铁固体洗涤、干燥、粉碎即可得电池级草酸亚铁,
(1)样品中的杂质主要为Al3+、Fe3+、TiO2+等,加入铁粉可以还原铁离子,调节溶液的PH值,使Al3+、TiO2+都水解产生沉淀而除去,根据图可知,须控制pH至少5为宜,才能使Al3+、TiO2+都水解产生沉淀,pH=3时除去杂质的反应离子方程式为TiO2++2H2O═H2TiO3↓+2H+,
故答案为:调节溶液的PH值;5;TiO2++2H2O═H2TiO3↓+2H+;
(2)随着pH的升高,氢氧化亚铁容易被空气中氧气氧化为氢氧化铁,反应的离子方程式为4Fe(OH)2+2H2O+O2═4Fe(OH)3,但溶液的PH值太小会导致氢氧化亚铁溶解,所以要保持合适的PH值,
故答案为:4Fe(OH)2+2H2O+O2═4Fe(OH)3;溶液的PH值太小会导致氢氧化亚铁溶解;
(3)“过滤②”步骤所得的滤液为硫酸亚铁、硫酸铵等,所以溶液吕含有阳离子为NH4+、Fe3+、H+,此外其中还含有一定量的H2C2O4,存在平衡H2C2O4?C2O42-+2H+,且K=Ka1•Ka2,当溶液的pH=2即c(H+)=10-2时,根据K=$\frac{{c}^{2}({H}^{+})•c(C{\;}_{2}O{\;}_{4}{\;}^{2-})}{c(H{\;}_{2}C{\;}_{2}O{\;}_{4})}$=Ka1•Ka2可知,c(C2O42-):c(H2C2O4)=$\frac{Ka{\;}_{1}•Ka{\;}_{2}}{{c}^{2}({H}^{+})}$=$\frac{5.9×10{\;}^{-2}×6.4×10{\;}^{-5}}{1{0}^{-4}}$=3.8×10-2,
故答案为:NH4+、Fe3+、H+;3.8×10-2;
(4)在“洗涤”步骤中,确认沉淀已洗涤干净的方法是取少量最一次洗涤滤液于试管中,加入足量的氯化钡溶液,没有出现白色浑浊,则说明已经洗涤干净,
故答案为:取少量最一次洗涤滤液于试管中,加入足量的氯化钡溶液,没有出现白色浑浊.
点评 本题考查了流程分析判断满屋子性质的分析和反应实验的现象和步骤是解题关键,沉淀溶解平衡常数的运用、除杂的分析应用是解题关键,题目难度中等.

 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案| A. | 一定大于92.0 kJ | B. | 一定等于92.0 kJ | C. | 一定小于92.0 kJ | D. | 不能确定 |
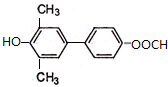
(1)可用纯碱、焦炭、氨气反应制取 NaCN,同时还有水生成,写出反应的化学方程式,并标明电子转移的方向和数目
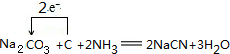 ;
;(2)现代采金技术先以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到 Na(二氰合金酸钠)溶液,再用锌还原 Na生成金,“浸取”反应的还原产物是NaOH;
(3)如图1为用含NaCN的废水合成黄血盐(K4Fe(CN)6)的主要工艺流程如图:

已知相同温度下溶解度:Na4Fe(CN)6>K4Fe(CN)6
①实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.
②在转化罐中发生反应的化学方程式为Na4[Fe(CN)6+4KCl=4NaCl+K4[Fe(CN)6↓.
③加入碳酸钠溶液主要目的是除去过量的Ca2+.
④“操作”环节具体为过滤、洗涤、干燥.
(4)CN -可以造成水体污染,某小组用如下方法对此污水进行处理如图2装置模拟电化学法处理CN -,有关结果如表.
| 实验序号 | 电极(X) | NaCl溶液浓度(mol/L) | 甲中石墨表面通人气体 | 电流计读数(A) |
| (1) | Fe | 0.l | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5Ⅰ |
| (3) | Fe | 0.1 | 02 | 2Ⅰ |
| (4) | Al | 0.5 | 空气 | 1.6Ⅰ |
②该实验表明电化学法处理CN-时,影响处理速率的因素有负极的金属材料、甲中电解质氯化钠的浓度以及氧气的浓度(任答两点)
| 选项 | 气体 | 试剂 | 现象 | 结论 |  |
| A | X | 酸性KMnO4溶液 | 溶液褪色 | X一定是SO2 | |
| B | NH3 | 酚酞溶液 | 溶液变红色 | 氨水呈碱性 | |
| C | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水有酸性和漂白性 | |
| D | NO2 | 淀粉KI溶液 | 溶液变蓝色 | NO2有还原性 |
| A. | A | B. | B | C. | C | D. | D |
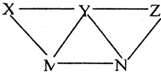 现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图所示的相互转化关系,图中每条连线两端的物质可以发生化学反应.则下列推断不合理的是( )
现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图所示的相互转化关系,图中每条连线两端的物质可以发生化学反应.则下列推断不合理的是( )| A. | Y一定为K2CO3 | B. | X一定为H2SO4 | C. | Z可能是氯水 | D. | M可能为FeSO4 |
| A. | 氯水 | B. | 盐酸 | C. | 液氯 | D. | 漂白精 |
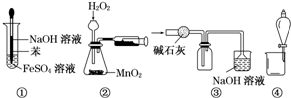
| A. | 图①可以用来制取Fe(OH)2沉淀 | |
| B. | 图②可以用来测定化学反应速率 | |
| C. | 图③可以用来收集一瓶纯净的SO2 | |
| D. | 图④可以用来分离水和乙醇的混合溶液 |
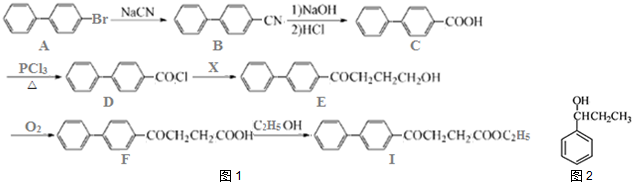
 .
.