题目内容
17.有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识.下图是某化学兴趣小组设计的乙醇催化氧化的实验装置.(提示:通常用新制的Cu(OH)2悬浊液产生砖红色沉淀来检验物质中含有醛基)
请据图回答以下问题:
(1)仪器连接安装完毕,进行实验前如何检验装置的气密性?答:关闭活塞K2,打开K1,点燃B处酒精灯,A中液体压入长管中;停止加热冷却至室温,A中恢复原状(或关闭K1,打开K2,点燃B处酒精灯,D中长管口冒气泡;停止加热冷却至室温,D中液体倒吸入长管形成一段水柱),说明气密性良好;
(2)对A中的乙醇采用水浴加热的目的是为使A中乙醇较长时间地平稳地气化成乙醇蒸气;
(3)实验时,点燃B处的酒精灯后,先预热直玻璃管,再集中火焰加热铜丝,随后向装置中不断地缓缓鼓入空气,此时B中观察到的现象是铜丝由红色变为黑色,很快又变为红色,发生的主要反应的化学方程式为2CH3CH2OH+O2$\stackrel{△}{→}$2CH3CHO+2H2O,当反应进行一段时间后,移去酒精灯,继续不断缓缓地鼓入空气,B中仍重复如上现象,说明B处发生的反应是一个放热反应(填“吸热”或“放热”).
(4)装置C的作用是检验乙醇氧化产生的H2O,能在此处观察到的现象是白色粉末变为蓝色晶体;
(5)装置D中的现象是产生砖红色沉淀.
分析 水浴加热条件下,乙醇挥发,与空气在B中发生催化反应,C用于检验生成水,D用于检验乙醛.
(1)装置气密性检验的原理是:通过气体发生器与液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;一般用到的方法有:空气热胀冷缩法、注水法、抽气或压气法等,据此进行分析解答即可;
(2)加热乙醇能够得到平稳的乙醇蒸汽;
(3)乙醇催化氧化过程中,铜先与氧气加热反应生成氧化铜,氧化铜再与乙醇反应生成乙醛和铜、水,移去酒精灯,继续不断缓缓地鼓入空气,B中仍重复如上现象,说明该反应为放热反应,放出的热量能够维持反应的进行;
(4)硫酸铜为白色固体,极易结合水生成蓝色的五水硫酸铜,通常用此检验水的存在;
(5)乙醛含有醛基能够与新制的氢氧化铜反应生成氧化亚铜、乙酸和水.
解答 解:水浴加热条件下,乙醇挥发,与空气在B中发生催化反应,C用于检验生成水,D用于检验乙醛.
(1)装置气密性检验的原理是:通过气体发生器与液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏,方法为:关闭活塞K2,打开K1,点燃B处酒精灯,A中液体压入长管中;停止加热冷却至室温,A中恢复原状(或关闭K1,打开K2,点燃B处酒精灯,D中长管口冒气泡;停止加热冷却至室温,D中液体倒吸入长管形成一段水柱),说明气密性良好;
故答案为:关闭活塞K2,打开K1,点燃B处酒精灯,A中液体压入长管中;停止加热冷却至室温,A中恢复原状(或关闭K1,打开K2,点燃B处酒精灯,D中长管口冒气泡;停止加热冷却至室温,D中液体倒吸入长管形成一段水柱),说明气密性良好;
(2)对A中的乙醇采用水浴加热的目的是为使A中乙醇较长时间地平稳地气化成乙醇蒸气;
故答案为:为使A中乙醇较长时间地平稳地气化成乙醇蒸气;
(3)乙醇催化氧化过程中,铜先与氧气加热反应生成氧化铜,氧化铜再与乙醇反应生成乙醛和铜、水,所以
实验时,点燃B处的酒精灯后,先预热直玻璃管,再集中火焰加热铜丝,看到的现象为:丝由红色变为黑色,很快又变为红色,反应方程式:2CH3CH2OH+O2$\stackrel{△}{→}$2CH3CHO+2H2O,移去酒精灯,继续不断缓缓地鼓入空气,B中仍重复如上现象,说明该反应为放热反应,放出的热量能够维持反应的进行;
故答案为:预热直玻璃管;铜丝由红色变为黑色,很快又变为红色;2CH3CH2OH+O2$\stackrel{△}{→}$2CH3CHO+2H2O;放热;
(4)硫酸铜为白色固体,极易结合水生成蓝色的五水硫酸铜,通常用此检验水的存在;
故答案为:检验乙醇氧化产生的H2O;白色粉末变为蓝色晶体;
(5)乙醛含有醛基能够与新制的氢氧化铜反应生成砖红色的氧化亚铜、乙酸和水,所以看到的现象为:产生砖红色沉淀;
故答案为:产生砖红色沉淀.
点评 本题考查了乙醇的催化氧化,为高频考点,侧重于学生的分析能力、实验能力的考查,明确乙醇的性质及催化氧化反应的原理是解题关键,题目难度不大.

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案| A. | Na2O2可用作呼吸面具中的供氧剂 | |
| B. | 氨气可做制冷剂 | |
| C. | Al(OH)3可作治疗胃酸过多的一种药剂 | |
| D. | 包装食品里常有硅胶、生石灰、还原铁粉等,其作用相同 |
(1)可用纯碱、焦炭、氨气反应制取 NaCN,同时还有水生成,写出反应的化学方程式,并标明电子转移的方向和数目
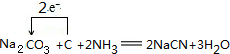 ;
;(2)现代采金技术先以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到 Na(二氰合金酸钠)溶液,再用锌还原 Na生成金,“浸取”反应的还原产物是NaOH;
(3)如图1为用含NaCN的废水合成黄血盐(K4Fe(CN)6)的主要工艺流程如图:

已知相同温度下溶解度:Na4Fe(CN)6>K4Fe(CN)6
①实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.
②在转化罐中发生反应的化学方程式为Na4[Fe(CN)6+4KCl=4NaCl+K4[Fe(CN)6↓.
③加入碳酸钠溶液主要目的是除去过量的Ca2+.
④“操作”环节具体为过滤、洗涤、干燥.
(4)CN -可以造成水体污染,某小组用如下方法对此污水进行处理如图2装置模拟电化学法处理CN -,有关结果如表.
| 实验序号 | 电极(X) | NaCl溶液浓度(mol/L) | 甲中石墨表面通人气体 | 电流计读数(A) |
| (1) | Fe | 0.l | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5Ⅰ |
| (3) | Fe | 0.1 | 02 | 2Ⅰ |
| (4) | Al | 0.5 | 空气 | 1.6Ⅰ |
②该实验表明电化学法处理CN-时,影响处理速率的因素有负极的金属材料、甲中电解质氯化钠的浓度以及氧气的浓度(任答两点)
 现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图所示的相互转化关系,图中每条连线两端的物质可以发生化学反应.则下列推断不合理的是( )
现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图所示的相互转化关系,图中每条连线两端的物质可以发生化学反应.则下列推断不合理的是( )| A. | Y一定为K2CO3 | B. | X一定为H2SO4 | C. | Z可能是氯水 | D. | M可能为FeSO4 |
| A. |  用如图所示装置制取少量H2 | |
| B. |  用如图所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 | |
| C. |  用如图所示装置制取少量Cl2 | |
| D. |  用如图所示装置确定导线中有电流通过及并确定电流方向 |
| A. | 氯水 | B. | 盐酸 | C. | 液氯 | D. | 漂白精 |
| A. | 氢氟酸要保存在塑料瓶中 | |
| B. | 新制的氯水要保存在无色细口瓶中,并放置在光亮处 | |
| C. | 少量液溴要保存在棕色细口瓶中,并在液溴面上加水封 | |
| D. | 单质碘要保存在棕色广口瓶中,并放置在阴凉处 |


 .
.