题目内容
13. 氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,他们应用广泛.
氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,他们应用广泛.(1)N2O是人类最早应用于医疗的麻醉剂之一.它可由NH4NO3在加热条件下分解产生,此反应的化学方程式为NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O.已知N2O与CO2分子具有相似的结构,试画出N2O的结构式N=N=O.
(2)N2O4可作火箭高能燃料N2H4的氧化剂.
已知:2NO2(g)?N2O4(g)△H=-akJ•mol-1;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-bkJ•mol-1;
N2(g)+2O2(g)=2NO2(g)△H=+ckJ•mol-1;(a、b、c均大于0).
写出气态腁在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-(c-a+2b)kJ•mol-1.
(3)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如p(NO2)=p总×x(NO2)).写出反应2NO2(g)?N2O4(g)△H=-akJ•mol-1平衡常数Kp表达式$\frac{x({N}_{2}{O}_{4})}{{P}_{总}•{x}^{2}(N{O}_{2})}$(用p总、各气体物质的量分数x表示).
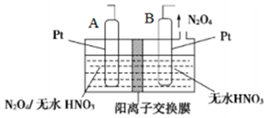
(4)新型绿色硝化剂N2O5可以N2O4为原料用电解法制备,实验装置如图所示.则电极B接直流电源的负极,电解池中生成N2O5的电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
(5)可用氨水吸收NO2、O2生成硝酸铵,写出该反应的离子方程式4NH3•H2O+4NO2+O2=4NH4++4NO3-+2H2O.
已知25℃时NH3•H2O的电离常数Kb=2×10-5,向500ml0.1mol•L-1硝酸铵溶液中通入标准状况下至少5.6ml氨气,是溶液呈中性(溶液的体积变化忽略不计).
分析 (1)根据氧化还原反应中得失电子相等结合原子守恒确定另一种生成物,写出相应的反应方程式;N2O与CO2具有相似的结构,应为直线形分子,且存在N=O键,相同原子间形成的共价键是非极性共价键;
(2)由①N2(g)+2O2(g)═2NO2(g)△H=+ckJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-b kJ/mol
③2NO2(g?N2O4(g)△H=-akJ/mol
根据盖斯定律可知②×2-①-③得热化学方程式;
(3)p(NO2)=p总×x(NO2),p(N2O4)=p总×x(N2O4),据此写出平衡常数表达式;
(4)由N2O4制取N2O5需要是失电子,所以N2O5在阳极区生成,A为阳极,B为阴极;
(5)氨水吸收NO2、O2生成硝酸铵,结合原子守恒配平书写化学方程式,溶液呈中性,依据电荷守恒计算可知,溶液中氢氧根离子浓度=10-7mol/L,c(NH4+)=c(NO3-),结合平衡常数计算.
解答 解:(1)该反应中化合价变化为:NH4NO3→N2O,N元素由-3价→+1价,一个N原子失去4个电子,由+5价→+1价,一个N原子得4个电子,所以得失电子数的最小公倍数为4,所以硝酸铵的计量数为1,根据原子守恒确定另一种生成物为H2O,然后根据原子守恒配平其它元素,所以该反应的化学方程式为:NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O,N2O与CO2具有相似的结构,应为直线形分子,且存在N=O键,N2O分子中氧原子只与一个氮原子相连,应为N=N=O结构,
故答案为:NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O; N=N=O;
(2)由①N2(g)+2O2(g)═2NO2(g)△H=+ckJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-b kJ/mol
③2NO2(g?N2O4(g)△H=-akJ/mol
根据盖斯定律可知②×2-①-③得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),△H=-(c-a+2b)kJ/mol,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-(c-a+2b)kJ•mol-1 ;
(3)2NO2(g)?N2O4(g),p(NO2)=p总×x(NO2),p(N2O4)=p总×x(N2O4),Kp=$\frac{{P}_{总}×x({N}_{2}{O}_{4})}{({P}_{总}×x(N{O}_{2}))^{2}}$=$\frac{x({N}_{2}{O}_{4})}{{P}_{总}•{x}^{2}(N{O}_{2})}$,
故答案为:$\frac{x({N}_{2}{O}_{4})}{{P}_{总}•{x}^{2}(N{O}_{2})}$;
(4)从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,A电极为阳极,反应式为N2O4+2HNO3-2e-=2N2O5+2H+,B为阴极与电源负极相连,
故答案为:负;N2O4+2HNO3-2e-=2N2O5+2H+;
(5)氨水吸收NO2、O2生成硝酸铵,反应的化学方程式为:4NH3•H2O+4NO2+O2=4NH4++4NO3-+2H2O,已知25℃时NH3•H2O的电离常数Kb=2×10-5,向500ml0.1mol•L-1硝酸铵溶液中通入氨气溶液呈中性,c(H+)=c(OH-)=10-7mol/L,c(NH4+)=c(NO3-),Kb=$\frac{1{0}^{-7}×0.1}{c(N{H}_{3}•{H}_{2}O)}$=2×10-5,c(NH3•H2O)=$\frac{1{0}^{-8}}{2×1{0}^{-5}}$=5×10-4mol/L,n(NH3)=5×10-4mol/L×0.5L=2.5×10-4mol,
标准状况下氨气体积=2.5×10-4mol×22.4L/mol=0.056L=56ml,
故答案为:4NH3•H2O+4NO2+O2=4NH4++4NO3-+2H2O; 5.6;
点评 本题涉及热化学方程式、化学平衡移动、化学计算、电解原理等知识点,主要是盖斯定律计算、氧化还原反应电子转移、电离平衡常数计算等,题目难度中等.

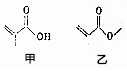
| A. | 甲、乙互为同分异构体 | |
| B. | 甲、乙都能发生取代、加成和水解反应 | |
| C. | 甲、乙都能使酸性的高锰酸钾褪色 | |
| D. | 等物质的量的甲和乙与足量的NaOH溶液反应,消耗NaOH的物质的量相等 |
(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(l)△H=-2869kJ•mol-1.
下列说法正确的是( )
| A. | 正丁烷分子储存的能量小于异丁烷 | |
| B. | 正丁烷的稳定性大于异丁烷 | |
| C. | 异丁烷转化为正丁烷的过程是一个放热过程 | |
| D. | 异丁烷转化为正丁烷的过程是一个吸热过程 |
| A. | 碘(海带) | B. | 溴(晒盐后的卤水) | C. | 乙烯(乙醇) | D. | 烧碱(氯化钠) |
| A | 实验操作 | 预测的实验现象 |
| B | 向Na2CO3溶液中滴加盐酸 | 立即有气体逸出 |
| C | 将浓硫酸滴加到盛有铜片的试管中,并将蘸有品红溶液的试纸置于试管口 | 试纸褪色 |
| D | 铅箔在酒精灯火焰上加热 | 铝熔化但不会滴下 |
| 向淀粉的水解液中加入新制Cu(OH)2悬浊液并加热 | 一定有砖红色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
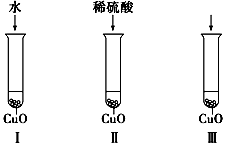 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过如图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过如图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.
 、K
、K .
.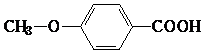 .(本题不考虑
.(本题不考虑 结构).
结构).