题目内容
17.物质在下列应用中,利用了其还原性的是( )| A. | 纯碱去油污 | B. | 明矾净水 | C. | 铝冶炼金属 | D. | 漂粉精漂白织物 |
分析 氧化还原反应中元素化合价升高作还原剂,表现还原性,据此分析.
解答 解:A.纯碱去油污,纯碱水解显碱性,油脂在碱性条件下水解,没有发生氧化还原反应,故A不选;
B.明矾净水,明矾中的铝离子水解生成氢氧化铝胶体吸附杂质而净水,没有发生氧化还原反应,故B不选;
C.铝冶炼金属,铝作还原剂把金属由化合物中置换出来,铝作还原剂,利用了其还原性,故C选;
D.漂粉精漂白织物,表现了次氯酸钙的强氧化性,故D不选;
故选C.
点评 本题考查氧化还原反应,把握元素的化合价与微粒性质的关系为解答的关键,侧重氧化性、还原性的考查,注意从元素的化合价角度分析,题目难度不大.

练习册系列答案
相关题目
7.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的简单气态氢化物的水溶液呈碱性,乙位于第ⅤA族,甲和丙同主族,丁的最外层电子数和电子层数相等,下列说法正确的是( )
| A. | 金属性:丙>甲 | |
| B. | 原子半径:r(丁)>r(丙)>r(乙)>r(甲) | |
| C. | 乙、丙、丁的简单离子的电子层结构相同 | |
| D. | 甲和乙以1:4形成的简单阳离子含11个电子 |
2.以下物质的工业制备所用主要原料(括号内物质)不符合事实的是( )
| A. | 碘(海带) | B. | 溴(晒盐后的卤水) | C. | 乙烯(乙醇) | D. | 烧碱(氯化钠) |
9.向一定量的Cu、CuO、Fe2O3的混合物中加入100mL1mol/L的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+.若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )
| A. | 0.8g | B. | 1.6g | C. | 2.4g | D. | 3.2g |
6.下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | Na2S有强还原性 | 用于除去废水中的Cu2+和Hg2+ |
| B | CaCO3是难溶物 | CaCl2溶液中通入CO2产生白色沉淀 |
| C | Zn具有还原性和导电性 | 可用作锌锰干电池的负极材料 |
| D | 浓H2SO4有强氧化性 | 浓H2SO4可用于干燥SO2 |
| A. | A | B. | B | C. | C | D. | D |
7.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使甲基橙变红色的溶液中:Na+、Al3+、SO42-、SiO32- | |
| B. | 碱性溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 0.1mol•L-1NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 与Al反应能放出H2的溶液中:Na+、Fe2+、ClO-、SO42- |
 、K
、K .
.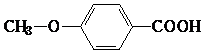 .(本题不考虑
.(本题不考虑 结构).
结构).