题目内容
下列图象表达正确的是( )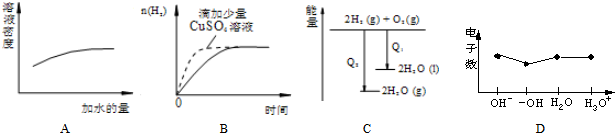

| A、浓硫酸的稀释 |
| B、过量的盐酸与等量的锌粉反应 |
| C、氢气与氧气反应中的能量变化 |
| D、微粒电子数 |
考点:溶液中溶质的质量分数及相关计算,原子构成,吸热反应和放热反应,反应热和焓变
专题:
分析:A、浓硫酸加水稀释密度减小;
B、形成原电池可加快化学反应速率,氢气的质量由锌粉的质量决定;
C、物质的燃烧是放热的,液态水变为气态水需要吸收热量;
D、原子的电子数等于质子数;阴离子中,电子数=质子数+电荷数,阳离子中,电子数=质子数-电荷数,以此来分析解答.
B、形成原电池可加快化学反应速率,氢气的质量由锌粉的质量决定;
C、物质的燃烧是放热的,液态水变为气态水需要吸收热量;
D、原子的电子数等于质子数;阴离子中,电子数=质子数+电荷数,阳离子中,电子数=质子数-电荷数,以此来分析解答.
解答:
解:A、浓硫酸加水稀释密度减小,图象与实际不相符,故A错误;
B、锌粉与硫酸铜反应生成了铜,消耗了锌粉,锌粉、铜和盐酸构成了原电池,加快了化学反应速率,但产生的氢气减少,图象与实际不相符,故B错误;
C、氢气的燃烧是放热的,但是液态水变为气态水需要吸收热量,所以氢气燃烧生成液态水放出的热量多,故C错误;
D、原子的电子数等于质子数;阴离子中,电子数=质子数+电荷数,阳离子中,电子数=质子数-电荷数,则OH-含有10个电子,-OH含有9个电子,H2O含10个电子,H3O+含有10 个电子,与图象一致,故D正确.
故选D.
B、锌粉与硫酸铜反应生成了铜,消耗了锌粉,锌粉、铜和盐酸构成了原电池,加快了化学反应速率,但产生的氢气减少,图象与实际不相符,故B错误;
C、氢气的燃烧是放热的,但是液态水变为气态水需要吸收热量,所以氢气燃烧生成液态水放出的热量多,故C错误;
D、原子的电子数等于质子数;阴离子中,电子数=质子数+电荷数,阳离子中,电子数=质子数-电荷数,则OH-含有10个电子,-OH含有9个电子,H2O含10个电子,H3O+含有10 个电子,与图象一致,故D正确.
故选D.
点评:本题考查了硫酸的密度、原电池原理的应用、反应热、微粒电子数的求算等知识,属于综合知识的考查,侧重于基础知识的应用的考查,难度中等.

练习册系列答案
相关题目
某溶液中存在大量的H+、NO3-、Cl-,该溶液中还可能大量存在的离子是( )
| A、CO32- |
| B、OH- |
| C、Ag+ |
| D、SO42- |
下列说法正确的是( )
| A、S2-电子排布式 1s22s22p63s23p4 |
| B、在金属晶体中,自由电子与金属离子或金属原子的碰撞有能量传递,可以用此来解释的金属的物理性质是导热性 |
| C、金属键可以看做是许多原子共用许多电子所形成的强烈相互作用,所以和共价键类似,也有饱和性和方向性 |
D、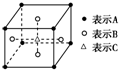 某物质的晶体中含A、B、C三种元素,其排列方式如图所示,晶胞中A、B、C的原子个数比为1:2:2. |
“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种.若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是溶液 ②是胶体 ③能产生丁达尔效应 ④静置后,会析出黑色沉淀( )
①是溶液 ②是胶体 ③能产生丁达尔效应 ④静置后,会析出黑色沉淀( )
| A、①④ | B、②③④ | C、②③ | D、①③ |
下列描述正确的是( )
| A、HCl和NaOH反应的中和热△H=-57.3kJ/mol,则NaOH和CH3COOH反应的中和热△H=-57.3kJ/mol |
| B、需要加热才能发生的反应一定是吸热反应 |
| C、CO(g)的燃烧热是-283.0kJ/mol,则2CO(g)+O2(g)=2CO2(g)反应的△H=-2×283.0kJ/mol |
| D、1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
下列说法正确的是( )
| A、沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 |
| B、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| C、根据是否有丁达尔效应将分散系分为溶液、胶体和浊液 |
| D、使用静电除尘器除去空气中的飘尘利用了胶体的性质 |
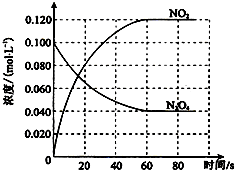 在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4g)═2NO2 (g),随温度升高,混合气体的颜色变深.
在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4g)═2NO2 (g),随温度升高,混合气体的颜色变深.