题目内容
9.下列实验装置、试剂选用或操作正确的是( )| A. |  分离NaCl、I2混合物 | B. |  干燥CO2气体 | ||
| C. |  稀释浓硫酸 | D. |  分离溴、CCl4混合物 |
分析 A.碘易升华,可加热分离;
B.气体进出方向错误;
C.不能在容量瓶中直接稀释溶液;
D.溴、四氯化碳混溶.
解答 解:A.碘易升华,可加热分离,可用升华的方法分离碘和氯化钠,故A正确;
B.用干燥管干燥气体,气体应从粗口进入,故B错误;
C.容量瓶只能用于配制一定浓度的溶液,不能在容量瓶中直接稀释溶液,故C错误;
D.溴、四氯化碳混溶,应用蒸馏的方法分离,故D错误.
故选A.
点评 本题考查较为综合,涉及物质的分离、溶液的配制等操作,为高考中常见的冷拼题,侧重学生的分析、实验能力的考查,注意把握实验的严密性和可行性的评价,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.现有室温下四种溶液,下列叙述不正确的是( )
| 序号 | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A. | ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大 | |
| B. | V1L④与V2L①混合,若混合后溶液pH=7,则V1<V2 | |
| C. | 分别加水稀释10倍后,四种溶液的pH①>②>④>③ | |
| D. | ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-) |
4.在下列各组物质中,属于同系物的一组是( )
| A. | 1,1-二溴乙烷和1,2-二溴乙烷 | B. | 苯和甲苯 | ||
| C. | 乙二醇和丙三醇 | D. | 乙烯和环丙烷 |
14.25℃时有关弱酸的电离平衡常数关系为:Ki(CH3COOH)>Ki1(H2CO3)>Ki(HCN)>Ki2(H2CO3).在冰醋酸中逐滴加水,溶液导电性和加水体积的关系如图所示.下列说法正确的是( )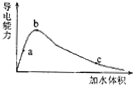

| A. | 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) | |
| B. | 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小 | |
| C. | 混合溶液中含有等物质的量的Na2CO3和NaHCO3,则一定存在c(Na+)+c(H+)═c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大于a |
1.25℃时,用浓度为0.1000mol/L的氢氧化钠溶液分别滴定20.00mL浓度均为0.l000mol/L的二种酸HX、HY(忽略体积变化),实验数据如下表,下列判断不正确的是( )
| 数据编号 | 滴入NaOH(aq)的体积/mL | 溶液的pH | |
| HX | HY | ||
| ① | 0 | 3 | 1 |
| ② | a | 7 | x |
| ③ | 20.00 | >7 | y |
| A. | 在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY | |
| B. | 由表中数据可估算出Ka(HX)≈10-5 | |
| C. | HY和HX混合,c(H+)=c(X-)+c(Y-)+c(OH-) | |
| D. | 上述②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
18.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol醇和2mol乙酸,该醇的分子式为( )
| A. | C14H18O5 | B. | C14H22O3 | C. | C16H26O5 | D. | C16H20O3 |
19.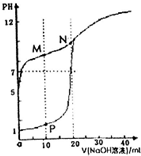 用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )
 用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )| A. | NaX溶液呈碱性 | B. | P点:c(Na+)>c(H+) | ||
| C. | M点:c(HX)+c(X-)=2c(Na+) | D. | M点水电离程度小于N点 |
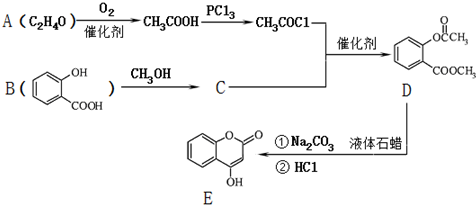
 .
. ;
;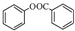 )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).