题目内容
4.在下列各组物质中,属于同系物的一组是( )| A. | 1,1-二溴乙烷和1,2-二溴乙烷 | B. | 苯和甲苯 | ||
| C. | 乙二醇和丙三醇 | D. | 乙烯和环丙烷 |
分析 同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团的有机化合物,官能团的种类与数目相同;
解答 解:A、A.1,1-二溴乙烷和1,2-二溴乙烷的分子式相同,结构不同,互为同分异构体,故A错误;
B、苯和甲苯的结构相似,分子组成相差1个CH2原子团,互为同系物,故B正确;
C、乙二醇和丙三醇分子中含有的羟基个数不同,不能互为同系物,故C错误;
D、乙烯和环丙烷是两类不同的物质,结构不相似,不能互为同系物,故D错误.
故选B.
点评 本题考查同系物的判断,难度不大,注意同系物必须含有官能团相同,且官能团的数目也相同,注意把握概念的内涵与外延.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
15.新型电池在飞速发展的信息技术中发挥着越来越重要的作用.Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用.其中一种制备Li2FeSiO4的方法为:
固相法:2Li2SiO3+FeSO4$\frac{\underline{\;惰性气体\;}}{高温}$Li2FeSiO4+Li2SO4+SiO2
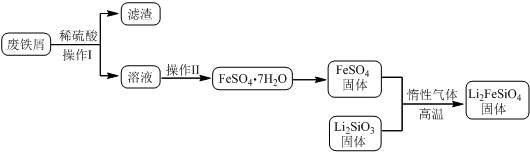
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量.
实验(一)制备流程:
实验(二) Li2FeSiO4含量测定:
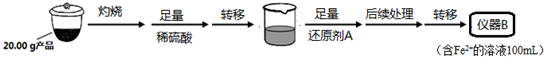
从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol•Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量.相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应.经4次滴定,每次消耗KMnO4溶液的体积如下:
(1)实验(二)中的仪器名称:仪器B100ml容量瓶,仪器C酸式滴定管.
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是防止二价铁被氧化.
(3)操作Ⅱ的步骤蒸发浓缩,降温结晶,过滤,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需玻璃棒.
(4)还原剂A可用SO2,写出该反应的离子方程式SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,此时后续处理的主要目的是除去过量的SO2,以免影响后面Fe2+的测定.
(5)滴定终点时现象为溶液变为浅红色,且半分钟内不变色;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为81%;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量偏高.(填“偏高”、“偏低”或“不变”).
固相法:2Li2SiO3+FeSO4$\frac{\underline{\;惰性气体\;}}{高温}$Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量.
实验(一)制备流程:

实验(二) Li2FeSiO4含量测定:

从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol•Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量.相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应.经4次滴定,每次消耗KMnO4溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是防止二价铁被氧化.
(3)操作Ⅱ的步骤蒸发浓缩,降温结晶,过滤,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需玻璃棒.
(4)还原剂A可用SO2,写出该反应的离子方程式SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,此时后续处理的主要目的是除去过量的SO2,以免影响后面Fe2+的测定.
(5)滴定终点时现象为溶液变为浅红色,且半分钟内不变色;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为81%;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量偏高.(填“偏高”、“偏低”或“不变”).
15.下表是几种弱酸常温下的电离平衡常数:
(1)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,则酸性最强的是H3PO4,最弱的是HPO42-.
(2)多元弱酸的二级电离程度远小于一级电离的原因是一级电离产生的H+对二级电离有抑制作用.
(3)温度相同时,同浓度的CH3COO-、HCO3-、CO32-、S2-的水解能力由强到弱的顺序为S2->CO32->HCO3->CH3COO-.
(4)在CH3COONa溶液中在相关离子浓度由大到小的顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
(5)根据K值大小判断下列反应能否发生:CH3COOH+H2PO4-→不能(填“能”或“不能”,下同) H2CO3+HS-→能.
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
(2)多元弱酸的二级电离程度远小于一级电离的原因是一级电离产生的H+对二级电离有抑制作用.
(3)温度相同时,同浓度的CH3COO-、HCO3-、CO32-、S2-的水解能力由强到弱的顺序为S2->CO32->HCO3->CH3COO-.
(4)在CH3COONa溶液中在相关离子浓度由大到小的顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
(5)根据K值大小判断下列反应能否发生:CH3COOH+H2PO4-→不能(填“能”或“不能”,下同) H2CO3+HS-→能.
19.下列叙述正确的是(NA表示阿伏加德罗常数值)( )
| A. | 1molC60F60分子中非极性共价键数目为60NA | |
| B. | 2.1gDTO分子中所含中子数为NA | |
| C. | 4.6gN2O4和NO2混合物中含的电子数为2.3NA | |
| D. | aml1mol/L的H2B溶液中,测得溶液中无H2B分子,则溶液中阴离子数为aNA |
9.下列实验装置、试剂选用或操作正确的是( )
| A. |  分离NaCl、I2混合物 | B. |  干燥CO2气体 | ||
| C. |  稀释浓硫酸 | D. |  分离溴、CCl4混合物 |
16.将1LpH=13 的氨水溶液加入水稀释到10.0L后,下列微粒浓度增大的是( )
| A. | c[NH3•H2O] | B. | c[H+] | C. | c[OH-] | D. | c[NH4+] |
13.下列关于元素周期表和元素周期律的说法错误的是( )
| A. | Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 | |
| B. | 第二周期元素从Li到F,金属性逐渐减弱,非金属性逐渐增强 | |
| C. | 因为Na比K容易失去电子,所以Na比K的还原性强 | |
| D. | O与S为同主族元素,且O比S的非金属性强 |
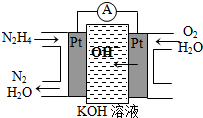 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题