题目内容
11.对某温度下的可逆反应N2(g)+3H2(g)?2NH3(g).下列事实能说明该反应达到化学平衡状态的是( )| A. | N2、H2的浓度之比保持不变 | |
| B. | N2和H2的反应速率之比为1:3 | |
| C. | NH3的生成速率与H2的生成速率之比为2:3 | |
| D. | 体系中N2、H2、NH3的分子个数之比为1:3:2 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、N2、H2的浓度之比保持不变,不能说明各自浓度不变,故A错误;
B、只要反应发生,就有N2和H2的反应速率之比为1:3,故B错误;
C、NH3的生成速率与H2的生成速率之比为2:3,速率之比等于对应物质的化学计量数之比,不能体现正与逆的关系,故C正确;
D、当体系达平衡状态时,N2、H2、NH3的分子个数之比可能为1:3:2,也可能不是1:3:2,与各物质的初始浓度及转化率有关,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
1.下列化学式表示的物质一定是纯净物的是( )
| A. | C4H10 | B. | C | C. |  | D. | C2H6O |
2.下列电子式的书写正确的是( )
| A. | Mg2+ | B. | S2- | C. |  | D. |  |
19.下列物质的熔、沸点高低顺序中,正确的是( )
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | I2>Br2>Cl2>F2 | ||
| C. | H2Te>H2Se>H2S>H2O | D. | 金刚石>CsCl>NaCl>钠 |
6.下列反应离子方程式正确的是( )
| A. | 向NaOH溶液中通入氯气:2OH-+Cl2═Cl-+ClO-+H2O | |
| B. | 氨气与盐酸反应:NH3+HCl═NH4++Cl- | |
| C. | 碳酸钙跟醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 将稀硝酸滴在铁片上:Fe+2H+═Fe2++H2↑ |
16.下列物质能发生消去反应且产物只有一种的是( )
| A. | (CH3)3COH | B. | CH3OH | C. | CH3CHICH2CH3 | D. | (CH3)3C-CH2Cl |
3.X、Y、Z、M为原子序数依次增大的四种短周期元素.X、Y、Z同周期且相邻,M为唯一一种金属元素且最外层电子数为X、Y、Z最外层电子数之和的$\frac{1}{5}$.下列说法不正确的是( )
| A. | X、Y、Z形成的气态氢化物中稳定性最强的是H2Z | |
| B. | Y所在族的氢化物的沸点最高的是Y对应的氢化物 | |
| C. | 离子半径的大小:M>Y>Z | |
| D. | M的最高价氧化物对应的水化物可以溶解于Y对应最高价含氧酸 |
6.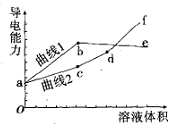 分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )
分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )
 分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )
分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )| A. | 曲线2 代表滴加NH3•H2O溶液的变化曲线 | |
| B. | b和d点对应的溶液均显碱性 | |
| C. | b点溶液中c(NH4+ )>c(SO42- )>c(H+ )>c(OH- ) | |
| D. | df段导电能力升高的原因是发生了反应Al(OH)3+OH-═[Al(OH)4]- |