题目内容
对于在一密闭容器中进行的下列反应:C(s)+O2(g)?CO2(g)下列说法中错误的是( )
| A、将木炭粉碎成粉末状可以加快化学反应速率 |
| B、升高温度可以加快化学反应速率 |
| C、增加压强不能加快化学反应速率 |
| D、增加木炭的量可以加快化学反应速率 |
考点:化学反应速率的影响因素
专题:化学平衡专题
分析:增大接触面积,升高温度、增大浓度等,均可加快反应速率,以此来解答.
解答:
解:A.将木炭粉碎成粉末状,接触面积增大,可以加快化学反应速率,故A正确;
B.升高温度,活化分子百分数增大,反应速率加快,故B正确;
C.压强增大,则反应速率加快,故C错误;
D.木炭为纯固体,则增加木炭的量,化学反应速率不变,故D错误;
故选CD.
B.升高温度,活化分子百分数增大,反应速率加快,故B正确;
C.压强增大,则反应速率加快,故C错误;
D.木炭为纯固体,则增加木炭的量,化学反应速率不变,故D错误;
故选CD.
点评:本题考查影响化学反应速率的因素,为高频考点,把握常见的影响反应速率的因素为解答的关键,注重基础知识的考查,注意纯固体不影响反应速率,题目难度不大.

练习册系列答案
相关题目
已知下列两个热化学方程式2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ/mol
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l);△H=-2220kJ/mol
实验测得氢气和丙烷的混合气体共0.5mol,完全燃烧时放出热量723.2kJ,则混合气体中氢气和丙烷的体积比约为( )
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l);△H=-2220kJ/mol
实验测得氢气和丙烷的混合气体共0.5mol,完全燃烧时放出热量723.2kJ,则混合气体中氢气和丙烷的体积比约为( )
| A、1:3 | B、2:3 |
| C、3:2 | D、3:1 |
下列关于浓HNO3和浓H2SO4的叙述中正确的是( )
| A、常温下都可用铝制容器贮存 |
| B、露置在空气中,容器内酸液的质量都减轻 |
| C、常温下都能与铜较快反应 |
| D、露置在空气中,容器内酸液的浓度都增大 |
如图是工业制纯碱的部分物质转化示意图,下列推测错误的是( )
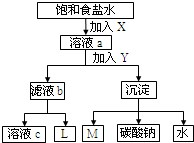

| A、若是氨碱法,溶液c可在转化流程中循环利用 |
| B、若是联碱法,则L的主要成分是NH3 |
| C、M可在转化流程中循环利用 |
| D、X是NH3,Y是CO2 |
如图是关于N2+3H2?2NH3△H<0的速率-时间图象,则t1时刻使平衡发生移动的原因是( )

| A、升高温度,同时增大压强 |
| B、降低温度,同时减小压强 |
| C、增大反应物的浓度,同时使用适宜的催化剂 |
| D、增大反应物的浓度,同时减小生成物的浓度 |
今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-,现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.792L(已换算成标准状况,且设气体全部逸出);②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.根据上述实验,以下推测正确的是( )
| A、一定不存在Ba2+,NH4+可能存在 |
| B、一定不存在Cl- |
| C、一定存在Na+ |
| D、可能存在Cl-、Na+ |