题目内容
7.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,漂白粉的有效成分是(填化学式)Ca(ClO)2有关化学反应方程式为2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O.
(2)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为Ca(ClO)2+CO2+H2O═CaCO3↓+2 HClO.
(3)O3与Cl2具有相似的性质,均可用于自来水的消毒.已知二者在消毒时均被还原为最低价态,则相同状况下10L O3与30L Cl2的消毒能力相当.
分析 (1)利用石灰乳和氯气反应生成氯化钙、次氯酸钙的混合物来制备漂白粉,根据反应生成物及性质分析;
(2)置露在空气的漂白粉与二氧化碳、水的反应生成具有漂白作用的次氯酸;
(3)根据消毒能力与发生氧化还原反应转移的电子数有关及电子守恒计算出需要量取的体积.
解答 解:(1)利用石灰乳和氯气反应生成氯化钙、次氯酸钙的混合物来制备漂白粉,发生反应:2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O
,漂白粉的有效成分是Ca(ClO)2,故答案为:Ca(ClO)2;2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O;
(2)置露在空气的漂白粉中的有效成分次氯酸钙与二氧化碳、水的反应生成具有漂白作用的次氯酸,即Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO,故答案为:Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO;
(3)相同条件下,气体的体积之比等于物质的量之比;消毒能力强弱与转移的电子数有关,若消毒能力相当,说明转移的电子数相等,所以若10L臭氧转移的电子数,需要氯气转移相同的电子数的体积为:$\frac{10×2×3}{2}$L=30L,
故答案为:30.
点评 本题考查漂白粉的制备及漂白原理,把握氯气的性质、次氯酸钙的性质、HClO的性质为解答的关键,明确发生的化学反应即可解答,题目难度不大.

练习册系列答案
相关题目
15.以下数值大于或等于阿伏加德罗常数的是( )
| A. | 6g石墨中的共价键数目 | |
| B. | 常温常压下,17g ND3中所含分子数目 | |
| C. | 0.1mol羟基(-OH)中所含电子数目 | |
| D. | 向0.2mol NH4Al(SO4)2溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目 |
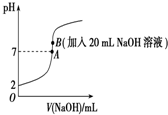
2. 15ml 0.1mol/L KOH溶液中滴入0.2mol/L(一元弱酸HA),溶液pH和加入弱酸HA体积的关系曲线如图所示,有关离子浓度的大小关系正确的是( )
15ml 0.1mol/L KOH溶液中滴入0.2mol/L(一元弱酸HA),溶液pH和加入弱酸HA体积的关系曲线如图所示,有关离子浓度的大小关系正确的是( )
 15ml 0.1mol/L KOH溶液中滴入0.2mol/L(一元弱酸HA),溶液pH和加入弱酸HA体积的关系曲线如图所示,有关离子浓度的大小关系正确的是( )
15ml 0.1mol/L KOH溶液中滴入0.2mol/L(一元弱酸HA),溶液pH和加入弱酸HA体积的关系曲线如图所示,有关离子浓度的大小关系正确的是( )| A. | 在A、B间任意一点(不包括A、B两点):c(K+)>c(A-)>c(OH-)>c(H+) | |
| B. | 在B点:c(A-)=c(K+)>c(OH-)=c(H+),且a=7.5 | |
| C. | 在C点:c(A-)>c(K+)>c(OH-)>c(H+) | |
| D. | 在D点:c(A -)+c(HA)>2 c(K+) |
12.下列有水参加的反应中,不属于盐类水解反应的是( )
| A. | NH4++H2O?NH3•H2O+H+ | |
| B. | Al3++3H2O?Al(OH)3+3H+ | |
| C. | CH3COO-+NH4++H2O?CH3COOH+NH3•H2O | |
| D. | HCO3-+H2O?H3O++CO32- |
19.甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成,将甲溶液分别与其他三种物质的溶液混合,均有沉淀和气体生成,则乙、丙、丁不可能是( )
| A. | NH4Cl | B. | Mg(HCO3)2 | C. | H2SO4 | D. | MgCl2 |
 ;
; 25℃下,向20mL 0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示,请回答下列问题:
25℃下,向20mL 0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示,请回答下列问题:



 .
. .
. .
.

 .
. .
. 等.(任写一种)
等.(任写一种)