题目内容
15.以下数值大于或等于阿伏加德罗常数的是( )| A. | 6g石墨中的共价键数目 | |
| B. | 常温常压下,17g ND3中所含分子数目 | |
| C. | 0.1mol羟基(-OH)中所含电子数目 | |
| D. | 向0.2mol NH4Al(SO4)2溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目 |
分析 A.石墨中每个碳原子含有共价键个数=3×0.5=1.5;
B.ND3的相对原子质量为20;
C.0.1mol羟基中含有0.9mol电子;
D.氢氧化钠先与铝离子反应生成氢氧化铝沉淀,然后与铵根结合生成一水合氨,最后使氢氧化铝溶液.
解答 解:A.石墨中每个碳原子含有共价键个数=3×0.5=1.5,含6 g碳元素的石墨晶体中,含有碳原子是0.5mol,共价键是0.5mol×1.5=0.75mol,其个数小于阿伏加德罗常数,故A错误;
B.17 g ND3的物质的量小于1mol,故B错误;
C.0.1mol羟基中含有0.9mol电子,所含的电子数目为0.9,故C错误;
D.氢氧化钠先与铝离子反应生成氢氧化铝沉淀,然后与铵根结合生成一水合氨,最后使氢氧化铝溶液,消耗的OH-数目为1mol,个数等于阿伏加德罗常数值,故D正确.
故选D
点评 本题考查了阿伏伽德罗常数的判断及计算,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握物质的量与阿伏伽德罗常数等物理量之间转化关系.

练习册系列答案
相关题目
16.扁桃酸甲酯是一种重要的化工产品.其结构如图所示,下列有关扁桃酸甲酯的说法中不正确的是( )
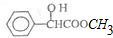
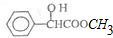
| A. | 分子式为C9H10O3 | |
| B. | 可以发生取代反应、加成反应、氧化反应和还原反应 | |
| C. | 1mol该物质最多可与4mol H2发生加成反应 | |
| D. | 其苯环上的二氯代物共有六种结构 |
10.用化学反应原理研究氮的氧化物和硫的氧化物有着重要的意义.
(1)已知:2SO2(g)+O2(g)?2SO3(g)△H1
2NO(g)+O2(g)?2NO2(g)△H2
NO2(g)+SO2(g)?SO3(g)+NO(g)△H3
则△H3=$\frac{△{H}_{1}-△{H}_{2}}{2}$ (用△H1、△H2 表示),如果上述三个反应方程式的平衡常数分别为K1、K2、K3,则K3=$\sqrt{\frac{{K}_{1}}{{K}_{2}}}$(用K1、K2 表示).
(2)如图1所示,A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2,分别将2mol NO 和1mol O2 通过K1、K3 分别充入A、B 中,发生的反应为2NO(g)+O2(g)?2NO2(g)[[不考虑2NO2(g)?N2O4(g)],起始时A、B 的体积相同均为a L.
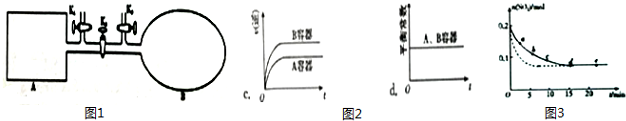
①下列说法和示意图2正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是a.
a.A、B 容器中气体的颜色均不再发生变化
b.A、B 容器中NO 和O2物质的量浓度比均为2:1
②T℃时,A 容器中反应达到平衡时的平衡常数Kp=8×10-2(kPa)-1.若A 容器中反应达到平 衡时p(NO2)=200kPa,则平衡时NO的转化率为66.7%. (Kp 是用平衡分压代替平衡浓=×度计算所得平衡常数,分压 总压 物质的量分数)
(3)将0.2mol SO2 和0.15mol O2通入2L 的密闭容器中,测得SO2的物质的量随时间变化如图3实线所示.
①ab段平均反应速率大于(填“大于”“小于”或“等于”)bc 段平均反应速率:de 段平均反应速率为0.
②仅改变某一个实验条件,测得SO2 的物质的量随时间变化如图3中虚线所示,则改变的条件加入催化剂是加入催化剂.
(1)已知:2SO2(g)+O2(g)?2SO3(g)△H1
2NO(g)+O2(g)?2NO2(g)△H2
NO2(g)+SO2(g)?SO3(g)+NO(g)△H3
则△H3=$\frac{△{H}_{1}-△{H}_{2}}{2}$ (用△H1、△H2 表示),如果上述三个反应方程式的平衡常数分别为K1、K2、K3,则K3=$\sqrt{\frac{{K}_{1}}{{K}_{2}}}$(用K1、K2 表示).
(2)如图1所示,A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2,分别将2mol NO 和1mol O2 通过K1、K3 分别充入A、B 中,发生的反应为2NO(g)+O2(g)?2NO2(g)[[不考虑2NO2(g)?N2O4(g)],起始时A、B 的体积相同均为a L.

①下列说法和示意图2正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是a.
a.A、B 容器中气体的颜色均不再发生变化
b.A、B 容器中NO 和O2物质的量浓度比均为2:1
②T℃时,A 容器中反应达到平衡时的平衡常数Kp=8×10-2(kPa)-1.若A 容器中反应达到平 衡时p(NO2)=200kPa,则平衡时NO的转化率为66.7%. (Kp 是用平衡分压代替平衡浓=×度计算所得平衡常数,分压 总压 物质的量分数)
(3)将0.2mol SO2 和0.15mol O2通入2L 的密闭容器中,测得SO2的物质的量随时间变化如图3实线所示.
| 编号 | a | b | c | d | e |
| n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
| t/min | 2 | 5 | 8 | 15 | 22 |
②仅改变某一个实验条件,测得SO2 的物质的量随时间变化如图3中虚线所示,则改变的条件加入催化剂是加入催化剂.
20.下列说法正确的是( )
| A. | 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:b>c>a | |
| B. | 常温下5.0×10-3mol•L-1KHA溶液的pH=3.75,该溶液中c(A2-)<c(H2A) | |
| C. | a mol/L的HCN溶液与b mol/L的NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b | |
| D. | Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) |
4.化学与生产和生活紧密相关,下列说法不正确的是( )
| A. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | 家庭用的“84”消毒液与洁厕灵能混合使用,不会发生中毒事故 | |
| C. | 可用蘸有浓氨水的玻璃棒检验输送氯气的管道是否漏气 | |
| D. | 硅胶可用作食品干燥剂 |
5.下列化学用语表示不正确的是( )
| A. | 钠离子的结构示意图: | |
| B. | 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl | |
| C. | 氢氧根离子的电子式: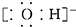 | |
| D. | NaHCO3的电离方程式:NaHCO3=Na++H++CO32- |