题目内容
7.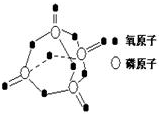 研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
| A. | 1057.5 kJ•mol-1 | B. | 335.25 kJ•mol-1 | C. | 433.75 kJ•mol-1 | D. | 959.0 kJ•mol-1 |
分析 白磷燃烧的方程式为P4+5O2=P4O10,根据化学键的断裂和形成的数目进行计算,由此分析解答.
解答 解:白磷燃烧的方程式为P4+5O2=P4O10,1mol白磷完全燃烧需拆开6mol P-P、5mol O=O,形成12molP-O、4mol P=O,
所以12mol×360kJ/mol+4mol×xkJ/mol-(6mol×197 kJ/mol+5 mol×499 kJ/mol)=2378.0kJ,
x=433.75,故选C.
点评 本题考查意热化学方程式的书写方法和计算应用,注意反应热的计算,特别是注意分析白磷的氧化磷的分子结构,正确判断共价键的类型和数目.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
18.实验室里需储存在棕色试剂瓶中的是( )
| A. | 金属钠 | B. | 浓硝酸 | C. | FeSO4溶液 | D. | 浓硫酸 |
19.常温常压下.甲烷与足量的氧气共60mL.点燃充分反应后.恢复到常温常压,剩余气体体积为24mL,则原混合气体中含甲烷( )
| A. | 25mL | B. | 17mL | C. | 18mL | D. | 25mL |
15.可以用SO42-+Ba2+═BaSO4↓表示的离子反应为( )
| A. | 稀硫酸与氧氧化钡溶液反应 | B. | 稀硫酸与氯化钡溶液反应 | ||
| C. | 稀硫酸与碳酸钡反应 | D. | 硫酸氢钠溶液与氢氧化坝溶液反应 |
12.下列说法错误的是( )
| A. | 浓硝酸与足量铜片反应时,先生成红棕色气体,后生成无色气体 | |
| B. | 浓硫酸具有强氧化性,常温下可将铝的单质氧化,因此,不能用铝罐车运输浓硫酸 | |
| C. | 饱和氯水既有酸性又有漂白性,加入NaHCO₃后漂白性减弱 | |
| D. | 浓盐酸与足量二氧化锰反应后,盐酸有剩余 |
19.下列说法正确的是( )
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | FeO俗称铁红 | |
| C. | Fe和水蒸气在高温条件下的反应产物是Fe2O3和H2 | |
| D. | 向FeCl2溶液中滴加NaOH,先生成白色沉淀迅速变成灰绿色,最终变为红褐色 |
17.下列实验操作及仪器的使用中,错误的是( )
| A. | 容量瓶和分液漏斗在使用前均要检验是否漏水 | |
| B. | 过滤和蒸馏都是利用微粒的大小来分离物质的一种物理方法 | |
| C. | 碘易溶于有机溶剂,可用CCl4萃取碘水中的碘 | |
| D. | 把几滴FeCl3饱和溶液滴入25mL沸水继续加热可制备Fe(OH)3胶体 |