题目内容
19.下列说法正确的是( )| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | FeO俗称铁红 | |
| C. | Fe和水蒸气在高温条件下的反应产物是Fe2O3和H2 | |
| D. | 向FeCl2溶液中滴加NaOH,先生成白色沉淀迅速变成灰绿色,最终变为红褐色 |
分析 A.赤铁矿为红色;
B.FeO为黑色;
C.Fe和水蒸气反应生成四氧化三铁;
D.生成的氢氧化亚铁被氧化生成氢氧化铁.
解答 解:A.赤铁矿为红色,则赤铁矿的主要成分是Fe2O3,故A错误;
B.FeO为黑色,Fe2O3俗称铁红,故B错误;
C.Fe和水蒸气在高温条件下的反应产物是Fe3O4和H2,故C错误;
D.向FeCl2溶液中滴加NaOH,生成的氢氧化亚铁被氧化生成氢氧化铁,则观察到先生成白色沉淀迅速变成灰绿色,最终变为红褐色,故D正确;
故选D.
点评 本题考查铁及其化合物的性质,为高考常见题型,把握物质的性质、发生的反应为解答的关键,侧重分析及应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
10.以下实验操作正确的是( )
| A. | 用燃着的酒精灯去点燃另一个酒精灯 | |
| B. | 用托盘天平称量氢氧化钠固体时,托盘里应该垫上纸进行称量 | |
| C. | 蒸发某溶液,待溶液中有大量晶体析出时即停止加热 | |
| D. | 浓硫酸稀释时,沿着烧杯壁将水慢慢加如到浓硫酸中,边加边搅拌 |
7.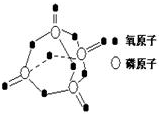 研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:
已知白磷的燃烧热为2378.0kJ/mol,白磷完全燃烧的产物结构如图所示,则上表中X= kJ•mol-1.( )
 研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
| A. | 1057.5 kJ•mol-1 | B. | 335.25 kJ•mol-1 | C. | 433.75 kJ•mol-1 | D. | 959.0 kJ•mol-1 |
11.NaOH固体溶于水,放出大量的热量是因为( )
| A. | 只发生水合过程 | B. | 只发生化学过程 | ||
| C. | 水合过程放热大于扩散过程吸热 | D. | 扩散过程吸热大于水合过程放热 |