题目内容
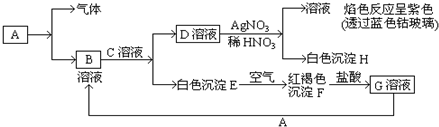
17.下列实验操作及仪器的使用中,错误的是( )| A. | 容量瓶和分液漏斗在使用前均要检验是否漏水 | |
| B. | 过滤和蒸馏都是利用微粒的大小来分离物质的一种物理方法 | |
| C. | 碘易溶于有机溶剂,可用CCl4萃取碘水中的碘 | |
| D. | 把几滴FeCl3饱和溶液滴入25mL沸水继续加热可制备Fe(OH)3胶体 |
分析 A.带有活塞或瓶塞的装置使用前要检查是否漏水;
B.蒸馏利用物质的沸点不同;
C.萃取剂的选取标准是:与水互不相溶,被萃取的物质在该溶剂中的溶解度比在水中的溶解度大,且跟萃取物不发生化学反应;
D.制备氢氧化铁胶体的方法是在沸水中滴加饱和氯化铁溶液,但不能长时间加热.
解答 解:A.带有活塞或瓶塞的装置使用前要检查是否漏水,容量瓶和分液漏斗在使用前均要检验是否漏水,故A正确;
B.蒸馏利用物质的沸点不同,可以实现互溶液体,并且沸点相差较大的液体的分离,故B错误;
C.CCl4与水不互溶;而且碘在CCl4中的溶解度比在水中的大很多,所以可用CCl4作萃取剂,故C正确;
D.制备氢氧化铁胶体的方法是在沸水中滴加饱和氯化铁溶液,当溶液呈红棕色时停止加热,故D正确.
故选B.
点评 本题考查化学实验的基本操作,题目难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
7.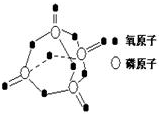 研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:
已知白磷的燃烧热为2378.0kJ/mol,白磷完全燃烧的产物结构如图所示,则上表中X= kJ•mol-1.( )
 研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
| A. | 1057.5 kJ•mol-1 | B. | 335.25 kJ•mol-1 | C. | 433.75 kJ•mol-1 | D. | 959.0 kJ•mol-1 |
5.某无色溶液中一定能大量共存的离子组是( )
| A. | Cu2+、Na+、NO3-、SO42- | B. | Ba2+、NH4+、Cl-、SO42- | ||
| C. | Na+、K+、ClO-、SO42- | D. | H+、Na+、I-、NO3- |
12.下列各组离子一定能大量共存的是( )
| A. | 在无色溶液中:K+、Cu2+、SO42-、NO3- | |
| B. | 在含Fe3+的溶液中:NH4+、Na+、Cl、OH- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、CO32- | |
| D. | 在强酸性的溶液中:K+、Na+、Cl-、CO32- |
2.设阿伏加德常数为NA,则下列说法正确的是( )
| A. | 1 L 0.1 mol/L MgCl2溶液中含Cl-数为0.1NA | |
| B. | 1mol Na完全转化为Na2O2时,失去的电子数目为2NA | |
| C. | 含有NA个氢原子的氢气的体积约为11.2L | |
| D. | 1.8g NH4+中所含电子数为NA |
7. 常温下,将氯气缓慢通入水中至饱和,再向其中缓慢滴加0.1 mol•L-1 NaOH溶液,整个过程中pH变化如图所示,下列有关叙述不正确的是( )
常温下,将氯气缓慢通入水中至饱和,再向其中缓慢滴加0.1 mol•L-1 NaOH溶液,整个过程中pH变化如图所示,下列有关叙述不正确的是( )
 常温下,将氯气缓慢通入水中至饱和,再向其中缓慢滴加0.1 mol•L-1 NaOH溶液,整个过程中pH变化如图所示,下列有关叙述不正确的是( )
常温下,将氯气缓慢通入水中至饱和,再向其中缓慢滴加0.1 mol•L-1 NaOH溶液,整个过程中pH变化如图所示,下列有关叙述不正确的是( )| A. | a点时,某同学用玻璃棒蘸取溶液滴在蓝色的石蕊试纸上,试纸最终变红 | |
| B. | a-b段,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$增大 | |
| C. | b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-) | |
| D. | c点对应溶液中:c(Na+)=2c(ClO-)+c(HClO) |