题目内容
16.设NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 在常温常压下11.2 L氢气所含的原子数目为NA | |
| B. | 18 g水所含的氢原子数目为NA | |
| C. | 2.3 g金属钠转化为Na2O和Na2O2的混合物时失去的电子数为0.1NA | |
| D. | 物质的量浓度为0.5 mol•L-1 的MgCl2溶液,含有的Cl- 数为1 NA |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、求出水的物质的量,然后根据水中含2个氢原子来分析;
C、求出钠的物质的量,然后根据钠反应后变为+1价来分析;
D、溶液体积不明确.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氢气的物质的量小于0.5mol,则含有的原子个数小于NA个,故A错误;
B、18g水的物质的量为1mol,而水中含2个氢原子,故1mol水中含2NA个氢原子,故B错误;
C、2.3g钠的物质的量为0.1mol,而钠反应后变为+1价,故0.1mol钠失去0.1NA个电子,故C正确;
D、溶液体积不明确,故溶液中的氯离子的个数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
11.下列物质中,所含分子数最少的是(NA表示阿伏加德罗常数)( )
| A. | 10g H2 | B. | 2molCl2 | C. | 1.5NACO2 | D. | 22.4LO2(标准状况) |
1.室温下,0.1mol/L氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )
①电离程度增大 ②$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 ③c(H+) 增大④导电性增强 ⑤$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大.
①电离程度增大 ②$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 ③c(H+) 增大④导电性增强 ⑤$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大.
| A. | 仅①②③ | B. | 仅①③④ | C. | 仅①③⑤ | D. | 仅②③④ |
8.下列说法正确的是( )
| A. | 摩尔质量就等于物质的式量 | |
| B. | 摩尔质量就是物质式量的6.02×1023倍 | |
| C. | HNO3的摩尔质量是63g | |
| D. | H2SO4和H3PO4的摩尔质量相等 |
5.下列说法中正确的是( )
| A. | 标准状况下,22.4L水中所含的分子数约为6.02×1023 | |
| B. | 标准状况下,aL的氧气和氮气的混合物含有的分子数约为a/22.4×6.02×1023 | |
| C. | 常温常压下,48g O3气体含有的氧原子数为6.02×1023 | |
| D. | 2.24L CO2中含有的原子数为0.3×6.02×1023 |
6.下列有关性质的比较中,不正确的是( )
| A. | 金属原子化热:Na<Mg<Al | B. | 晶格能:NaBr<NaCl<MgO | ||
| C. | 键的极性:N-H<O-H<F-H | D. | 熔点: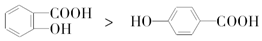 |