题目内容
7.CO在人类社会的发展过程中扮演着多重角色.既有其为人类服务”功臣”的一面,也有作为大气重要污染物“罪人”的一面.请回答下列问题:(1)CO是工业冶炼金属的重要还原剂之一,已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8KJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2KJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19.3KJ/mol
则CO还原FeO的热化学方程式是CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol.
(2)工业上可利用甲烷与水蒸气反应制备CO原料气:CH4(g)+H2O(g)═CO(g)+3H2(g).图1是CH4(g)与H2O(g)体积比为1:3时,平衡体系中甲烷的体积分数受温度、压强影响的关系图:
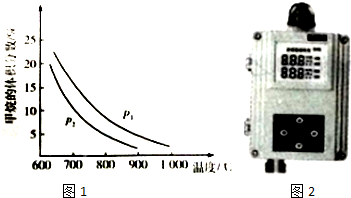
①甲烷与水蒸气制备CO的反应为吸热(填“放热”或“吸热”)反应,压强:P2<P1(填“>”或“<”).
②在恒温、恒压的条件下,向上述平衡体系中通人氮气,平衡向正反应方向(填“向正反应方向”“向逆反应方向”或“不”)移动.
(3)CO与水蒸气反应可制备氢气:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0.已知800℃时,在容积为2L的恒容密闭容器中充入0.2mol水蒸气和0.2molCO发生上述可逆反应.经过5min,反应达到平衡状态,此时测得平均反应速率v(CO2)=0.01mol/(L•min),则该温度下的平衡常数K=1,达到平衡时CO的转化率为50%.
(4)一氧化碳报警器(如图2)可检测环境中一氧化碳的浓度,其化学反应原理是CO与O2反应生成CO2,其工作原理是当CO通过外壳上的气孔经透气膜扩散到电极上时,在电极表面催化剂的作用下,在水的参与下被氧化,该电极的电极反应式为CO+H2O-2e-=CO2+2H+.
分析 (1)①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19.3kJ/mol
依据盖斯定律①×3-(③×2+②)得到:6CO(g)+6FeO(s)=6Fe(g)+6CO2(g)的△H,得到热化学方程式.
(2)①升高温度,化学平衡向着吸热方向进行,甲烷的体积分数减小;增加压强,甲烷的体积分数增大,据此回答;
②在恒温、恒压的条件下,向上述平衡体系中通人氮气,相当于体系减压,所以平衡正向移动;
(3)①根据平衡常数表达式结合三行式计算化学平衡常数;转化率等于变化量和初始量的比值;
(4)CO与O2反应生成CO2的燃料电池负极上是燃料燃烧的反应,据此回答.
解答 解:(1)①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19.3kJ/mol
依据盖斯定律①×3-(③×2+②)得到:6CO(g)+6FeO(s)=6Fe(g)+6CO2(g)△H=-66KJ/mol;得到热化学方程式为:CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol,
故答案为:CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol;
(2)①压强不变,升高温度,化学平衡向着吸热方向进行,甲烷的体积分数减小,所以正向进行,反应是吸热的;温度不变,增加压强,甲烷的体积分数增大,所以P1大;故答案为:吸热;<;
②在恒温、恒压的条件下,向上述平衡体系中通人氮气,相当于体系减压,所以平衡正向移动,故答案为:向正反应方向;
(3)CO+H2O(g)?CO2+H2,经过5min,反应达到平衡状态,此时测得平均反应速率v(CO2)=0.01mol/(L•min),得到二氧化碳的变化浓度是0.05,
初始浓度:0.1 0.1 0 0
变化浓度:0.05 0.05 0.05 0.05
平衡浓度:0.05 0.05 0.05 0.05
化学平衡常数K=$\frac{0.05×0.05}{0.05×0.05}$=1,达到平衡时CO的转化率为$\frac{0.05}{0.1}$×100%=50%;
故答案为:1;50%;
(4)CO与O2反应生成CO2的燃料电池负极上是燃料燃烧的反应,即CO+H2O-2e-=CO2+2H+,故答案为:CO+H2O-2e-=CO2+2H+.
点评 本题涉及热化学、化学平衡的计算以及化学平衡的移动、电化学等方面的知识,属于综合知识的考查题,难度不大.

 天天练口算系列答案
天天练口算系列答案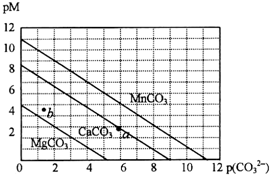 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列说法正确的是( )| A. | M离子浓度越大,pM值越大 | |
| B. | MgCO3、CaCO3、MnCO3的Ksp依次增大 | |
| C. | b点表示MgCO3为不饱和溶液,若表示CaCO3则有沉淀析出 | |
| D. | a点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
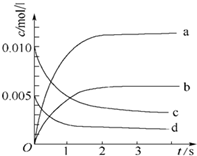 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b.用O2表示从0~2s内 该反应的平均速率v=1.5×10-3mol•L-1•s-1
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变 c.v正(NO)=2v逆(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是bcd.
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
(5)平衡时NO的转化率为:65%.
| A. | 在常温常压下11.2 L氢气所含的原子数目为NA | |
| B. | 18 g水所含的氢原子数目为NA | |
| C. | 2.3 g金属钠转化为Na2O和Na2O2的混合物时失去的电子数为0.1NA | |
| D. | 物质的量浓度为0.5 mol•L-1 的MgCl2溶液,含有的Cl- 数为1 NA |
| A. | 工业上电解熔融Al2O3制备金属铝 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 金属锌与稀硫酸反应制取氢气,粗锌比纯锌反应速率快 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |

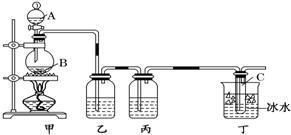
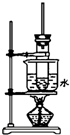 如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石棉网).
如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石棉网).