题目内容
9.根据你所学习的元素周期律和周期表知识回答下列相关问题:(1)现有部分短周期元素的性质或原子结构如表:
| 元素编号 | 元素性质或原子结构 |
| T | 单质是一种淡黄色固体,是黑火药成分之一 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
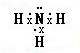 ,其水溶液呈碱性的原因是(用电离方程式表示):NH3•H2O?NH4++OH-.
,其水溶液呈碱性的原因是(用电离方程式表示):NH3•H2O?NH4++OH-.②元素Z与元素T相比,非金属性较强的是Cl(填元素符号).
③探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填化学式).
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:

①ⅡA族元素的最外层电子数(填字母)b.
②第三周期元素的最高化合价(填字母)c.
③N3-、O2-、F-、Na+、Mg2+、Al3+的离子半径(填字母)a.
(3)周期表中某些元素化合物的易燃性、毒性变化有一定规律性,例如:
①氢化物的易燃性:第二周期CH4>NH3>H2O>HF;
第三周期SiH4>PH3>H2S>HCl(填化学式).
②化合物的毒性:PH3>NH3,H2S>H2O.CS2>CO2,(选填>、<或=).
分析 (1)短周期元素,T元素对应的单质是一种淡黄色固体,是黑火药成分之一,则T为S元素;X元素原子最外层电子数是次外层电子数的2倍,则X原子只能有2个电子层,最外层电子数为4,则X为C元素;常温下Y元素单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;Z元素最高正价是+7价,则Z为Cl元素;
(2)①根据同一主族元素的最外层电子数相等;
②元素的最高正价=最外层电子数=族序数,同一周期元素的最高化合价逐渐增大;
③核外电子数相同,则核内质子数越多,对核外电子的吸引程度越大,半径越小;
(3)①根据非金属性的递变规律分析;
②由毒性PH3>NH3,可猜测同主族化合物的毒性.
解答 解:(1)短周期元素,T元素对应的单质是一种淡黄色固体,是黑火药成分之一,则T为S元素;X元素原子最外层电子数是次外层电子数的2倍,则X原子只能有2个电子层,最外层电子数为4,则X为C元素;常温下Y元素单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;Z元素最高正价是+7价,则Z为Cl元素,
①氨气的电子式为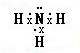 ,其水溶液呈碱性的原因是NH3•H2O?NH4++OH-,
,其水溶液呈碱性的原因是NH3•H2O?NH4++OH-,
故答案为: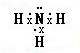 ;NH3•H2O?NH4++OH-;
;NH3•H2O?NH4++OH-;
②同周期随原子序数增大非金属性减弱,故非金属性较强的是Cl,故答案为:Cl;
③T、X、Y、Z四种元素的最高价氧化物的水化物分别为:H2SO4、H2CO3、HNO3、HClO4,碳酸是弱酸,其它酸为强酸,碳酸明显不同于其他三种,
故答案为:H2CO3;
(2)①因同一主族元素的最外层电子数相等,故答案为:b;
②因元素的最高正价=最外层电子数=族序数,同一周期元素的最高化合价逐渐增大,故答案为:c;
③核外电子数相同,则核内质子数越多半径越小,所以离子半径为:N3->O2->F->Na+>Mg2+>Al3+,故答案为:a.
(3)①同周期元素从左到右非金属性逐渐增强,对应的氢化物的还原性逐渐减弱,则同周期氢化物的易燃性从左到右逐渐减弱,即:CH4>NH3>H2O>HF,SiH4>PH3>H2S>HCl,故答案为:CH4;NH3;H2S;HCl;
②由毒性PH3>NH3,可知同主族化合物的毒性一般从上到下逐渐增强,则有:H2S>H2O、CS2>CO2,故答案为:>;>.
点评 本题考查物质的性质在周期表中的递变规律,为高频考点,题目难度中等,解答本题时,注意根据题中信息,找出相对应的递变规律.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案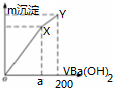
| A. | a=150 | |
| B. | Y点对应溶液为氨水 | |
| C. | OX、XY两段沉淀种类相同 | |
| D. | 继续滴加Ba(OH)2溶液,发生的离子反应为Al(OH)3+OH-═AlO2-+2H2O |
| A. | 乙醇、甲苯、硝基苯 | B. | 苯、四氯化碳、己烯 | ||
| C. | 苯、甲苯、环己烷 | D. | 乙酸乙酯、溴苯、乙酸 |
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| B. | 煤的干馏和气化都是物理变化 | |
| C. | 氯水、氨水、王水是混合物,水银、水玻璃是纯净物 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |

 CH3COOCH(CH3)2+H2O,取代反应或酯化反应反应类型
CH3COOCH(CH3)2+H2O,取代反应或酯化反应反应类型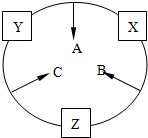 原子序数之和为16的三种短周期元素x、y、z对应的单质 X、Y、Z,常温常压下均为无色气体,在适当条件下单质X、Y、Z之间可以发生如图所示的变化.已知B分子组成中z原子个数比C分子中少一个.
原子序数之和为16的三种短周期元素x、y、z对应的单质 X、Y、Z,常温常压下均为无色气体,在适当条件下单质X、Y、Z之间可以发生如图所示的变化.已知B分子组成中z原子个数比C分子中少一个. .
.