题目内容
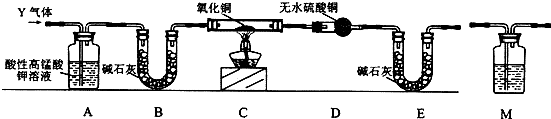
1.研究性学习小组进行CH4的制备及性质探究实验.根据反应:CH3COONa(固体)+NaOH(固体)=Na2CO3+CH4↑制备气体.
用CH4气体分别进行下列实验:
①通入酸性KmnO4溶液,现象是高锰酸钾紫红色不褪色.
②在无色玻璃集气瓶中与C12混合后光照,现象是集气瓶内气体颜色变浅,有油状液体生成.
分析 ①甲烷化学性质稳定,与酸、碱、溴水以及酸性高锰酸钾溶液不反应,不能够被高锰酸钾溶液氧化;
②在无色玻璃集气瓶中与Cl2混合后光照,甲烷和氯气发生取代反应,现象为黄绿色逐渐褪去,瓶壁有少量无色油状小液滴生成.
解答 解:①高锰酸钾具有强氧化性,具有还原性的物质能被高锰酸钾氧化,从而使高锰酸钾褪色,甲烷化学性质稳定,不能够被高锰酸钾溶液氧化,所以高锰酸钾紫红色不褪色,
故答案为:高锰酸钾紫红色不褪色;
②氯气为黄绿色气体,甲烷可以和氯气放生取代反应;生成一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷,其中一氯甲烷为气体,其余为液体,所以反应现象为集气瓶内气体颜色变浅,有油状液体生成,
故答案为:集气瓶内气体颜色变浅,有油状液体生成.
点评 本题考查甲烷的性质,题目难度不大,注意相关基础知识的积累,注意CH4化学性质稳定,与酸、碱、溴水以及酸性高锰酸钾溶液不反应,为高频考点.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
7. 如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )
如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )
 如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )
如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )| A. | 大理石和稀硫酸制取二氧化碳 | B. | 锌粒和稀硫酸制氢气 | ||
| C. | 块状碳酸钠和稀盐酸制取二氧化碳 | D. | 氯酸钾和二氧化锰制氧气 |
9.根据你所学习的元素周期律和周期表知识回答下列相关问题:
(1)现有部分短周期元素的性质或原子结构如表:
①元素Y的氢化物的电子式为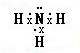 ,其水溶液呈碱性的原因是(用电离方程式表示):NH3•H2O?NH4++OH-.
,其水溶液呈碱性的原因是(用电离方程式表示):NH3•H2O?NH4++OH-.
②元素Z与元素T相比,非金属性较强的是Cl(填元素符号).
③探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填化学式).
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:

①ⅡA族元素的最外层电子数(填字母)b.
②第三周期元素的最高化合价(填字母)c.
③N3-、O2-、F-、Na+、Mg2+、Al3+的离子半径(填字母)a.
(3)周期表中某些元素化合物的易燃性、毒性变化有一定规律性,例如:
①氢化物的易燃性:第二周期CH4>NH3>H2O>HF;
第三周期SiH4>PH3>H2S>HCl(填化学式).
②化合物的毒性:PH3>NH3,H2S>H2O.CS2>CO2,(选填>、<或=).
(1)现有部分短周期元素的性质或原子结构如表:
| 元素编号 | 元素性质或原子结构 |
| T | 单质是一种淡黄色固体,是黑火药成分之一 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
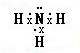 ,其水溶液呈碱性的原因是(用电离方程式表示):NH3•H2O?NH4++OH-.
,其水溶液呈碱性的原因是(用电离方程式表示):NH3•H2O?NH4++OH-.②元素Z与元素T相比,非金属性较强的是Cl(填元素符号).
③探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填化学式).
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:

①ⅡA族元素的最外层电子数(填字母)b.
②第三周期元素的最高化合价(填字母)c.
③N3-、O2-、F-、Na+、Mg2+、Al3+的离子半径(填字母)a.
(3)周期表中某些元素化合物的易燃性、毒性变化有一定规律性,例如:
①氢化物的易燃性:第二周期CH4>NH3>H2O>HF;
第三周期SiH4>PH3>H2S>HCl(填化学式).
②化合物的毒性:PH3>NH3,H2S>H2O.CS2>CO2,(选填>、<或=).
16.向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起.上述实验过程中没有发生的离子反应是( )
| A. | CO2+2OH-=CO32-+H2O | B. | Al2O3+2OH-=2 AlO2-+H2O | ||
| C. | 2 Al+2OH-+2H2O=2 AlO2-+3H2↑ | D. | Al3++4 OH-=AlO2-+2H2O |
6.化学与生活、社会密切相关,下列说法正确的是( )
| A. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 | |
| B. | 通信光缆的主要成分是晶体Si,太阳能电池的材料主要是SiO2 | |
| C. | 高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性 | |
| D. | 氨很容易液化,液氨气化吸收大量的热,所以液氨常用作致冷剂 |
10.下列有机物属于烃类的是( )
| A. | CH3Cl | B. | C2H6 | C. | C2H5OH | D. | CH3COOH |
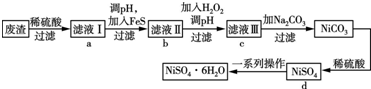
 .
.