题目内容
用如图实验装置进行相应实验,装置正确且能达到实验目的是( )
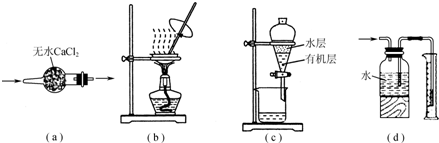

| A、用图a所示装置干燥SO2气体 |
| B、用图b所示装置蒸发CH3COONa溶液得醋酸钠晶体 |
| C、用图c所示装置分离有机层与水层,水层从分液漏斗下口放出 |
| D、用图d所示装置测量氨气的体积 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.干燥气体,大口进,小口出;
B.图为蒸发结晶操作;
C.水在上层,分液时避免上下层液体混合;
D.氨气极易溶于水.
B.图为蒸发结晶操作;
C.水在上层,分液时避免上下层液体混合;
D.氨气极易溶于水.
解答:
解:A.干燥气体,大口进,小口出,图中气体的进入方向不合理,故A错误;
B.图为蒸发结晶操作,并利用玻璃棒不断搅拌,操作合理,故B正确;
C.水在上层,分液时避免上下层液体混合,则水层从分液漏斗上口倒出,故C错误;
D.氨气极易溶于水,不能将水排出测定其体积,故D错误;
故选B.
B.图为蒸发结晶操作,并利用玻璃棒不断搅拌,操作合理,故B正确;
C.水在上层,分液时避免上下层液体混合,则水层从分液漏斗上口倒出,故C错误;
D.氨气极易溶于水,不能将水排出测定其体积,故D错误;
故选B.
点评:本题考查化学实验方案的评价,为高频考点,涉及气体的干燥、蒸发、分液及气体体积测定等,把握物质的性质及实验基本操作为解答的关键,侧重实验技能的考查,注意操作的可行性、评价性分析,题目难度不大.

练习册系列答案
相关题目
化学无处不在,下列与化学有关的说法正确的是( )
| A、液氨汽化时能吸收大量的热,故可用作制冷剂 |
| B、SO2能漂白纸浆等,故可广泛用于食品的漂白 |
| C、味精的主要成分是蛋白质,烧菜时可加入适量 |
| D、氢氟酸可用于雕刻玻璃制品,这是利用酸的通性 |
化学与生产、生活、社会密切相关,下列有关说法中不正确的是( )
| A、合金材料中可能含有非金属元素 |
| B、人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
| C、人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物 |
| D、柠檬、桔子等虽然是具有酸味的水果,但属于碱性食物 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、0.1 mol?L-1 Fe(NO3)2溶液:Mg2+、H+、SO42-、Cl- |
| B、0.1 mol?L-1 Ag(NH3)2OH溶液:Na+、H+、Cl-、NO3- |
| C、与金属铝能产生大量H2的溶液:K+、Na+、HCO3-、NO3- |
| D、c(H+)+c(OH-)=2×10-7mol?L-1的溶液:K+、Na+、Br-、Cl- |
下列有关物质性质的应用正确的是( )
| A、P2O5能与水反应,可用于干燥氨气 |
| B、MgO是一种电解质,工业上常用电解MgO冶镁 |
| C、福尔马林具有防腐杀菌效果,可用于浸制生物标本 |
| D、PbO2具有氧化性和导电性,可用作铅蓄电池负极材料 |
下列表述正确的是( )
| A、由水电离出的c(H+)=10-13mol?L-1的溶液中,Na+、NO3-、SO42-、Cl-一定能大量共存 |
| B、与强酸、强碱都能反应的物质种类只有两性氧化物或两性氧氧化物 |
| C、在NaHS溶液中存在的电离有:NaHS=Na++HS-,HS-?H++S2-,H2O?H++OH-,S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH- |
| D、若酸性HA>HB,则等物质的量浓度等体积的NaA和NaB溶液混合后,离子浓度关系为:c(OH-)>c(B-)>c(A-)>c(H+) |
下列有关实验原理或实验操作正确的是( )
| A、用水湿润pH试纸测量某溶液的pH |
| B、用50mL酸式滴定管可准确量取25.00mL KMnO4溶液 |
| C、用湿润的蓝色石蕊试纸检验氨气 |
| D、盛放NaOH溶液时,使用带玻璃塞的磨口瓶 |
下列离子方程式表达正确的是( )
| A、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| B、向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |
| C、向H2O中投入少量Na218O2固体:2H2O+2Na218O2═4Na++418 OH-+O2↑ |
| D、用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |