题目内容
12.工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”.并能以它们为原料生产一系列化工产品.为提高原料的利用率,节能降耗.设计如图1所示工艺流程,其中氯碱工业装置中的电极未标出.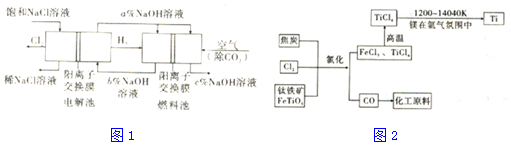
(1)电解饱和食盐水的化学方程式为2Cl-+2H2$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑.
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,正确的操作步骤的顺序是B (填序号).
①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
A.①④①②⑤③B.①②⑤④①③C.①②④⑤③D.④②⑤
(3)图中NaOII溶液的质量分数a%、b%、c%,由大到小的顺序为c%>a%>b%.
(4)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐.已知常温下,浓度均为0.1mol/L的四种钠盐溶液pH如表,下列说法不正确的是BD(填序号).
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是HClO
D.四种盐的阴离子结合H+能力最强的是HCO3-
(5)若利用电解氯化钠溶液所得的气体制36.5%的浓盐酸100t,最少需要消耗食盐58.5t.
(6)氯碱工业产品Cl2可用于冶炼钛铁矿得到金属钛,流程如图2.写出钛铁矿经氯化法得到四氯化钛的化学方程式:2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO.
(7)氮气和氩气是两种化学性质相对稳定的气体.镁还原TiCl4的反应中为防止Mg和Ti被氧化选择稀有气体氩气.试用化学反应方程式解释不选用氮气的原因:3Mg+N2$\frac{\underline{\;高温\;}}{\;}$Mg3N2.
分析 (1)电解饱和食盐水可以得到烧碱、氢气和氯气;
(2)可先把泥沙过滤去除,加过量Na2CO3溶液可除去Ca2+和过量的Ba2+,因此Na2CO3溶液必须放在BaCl2溶液后面添加即可,另外在加适量盐酸之前,要把形成的沉淀过滤;
(3)根据燃烧池中正、负极电极反应判断NaOII溶液质量分数的变化;
(4)A.由表中pH大小可知,酸性H2SO3>H2CO3>HClO>HCO3-,向氯水中加入NaHCO3,NaHCO3只与盐酸反应而不与HClO;B.盐类的水解促进水的电离,对于强碱弱酸盐而言,同温度下pH越大,说明水解程度越大,水的电离程度越大;
C.由表中pH大小可知,酸性H2SO3>H2CO3>HClO>HCO3-,根据酸性强弱判断pH的大小;
D.酸性越弱,其离子结合H+能力越强;
(5)由2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑和Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl,可得关系式NaCl~HCl,质量之比等于相对分子质量与化学计量数的积之比;
(6)由图2可知反应物有FeTiO3、Cl2、C,产物是FeCl3、TiCl4、CO,配平即可得到化学方程式;
(7)高温条件下,Mg和氮气反应生成氮化镁.
解答 解:(1)电解饱和食盐水可以得到烧碱、氢气和氯气,化学方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,改写为离子方程式为2Cl-+2H2$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑,
故答案为:2Cl-+2H2$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑;
(2)除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可先把泥沙过滤去除,所得滤液中加过量的氯化钡的目的是除去硫酸根离子,加过量NaOH溶液的目的是除去Mg2+,加过量碳酸钠溶液的目的是去除过量的钡离子和Ca2+.故Na2CO3溶液的加入一定在BaCl2溶液之后即可,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,由于盐酸能使生成的沉淀溶解,故加盐酸之前一定要过滤,故操作顺序可以是:①②⑤④①③或①⑤②④①③或①⑤④②①③,
故答案为:B;
(3)在燃料池中,负极反应式为H2+2OH--2e-=2H2O,导致NaOH溶液质量分数减小,即为b%<a%,
正极反应式为O2+2H2O+4e-=4OH-,导致NaOH溶液质量分数增大,即为a%<c%,因此c%>a%>b%,
故答案为:c%>a%>b%;
(4)A.由表中pH大小可知,酸性H2SO3>H2CO3>HClO>HCO3-,向氯水中加入NaHCO3,NaHCO3只与盐酸反应而不与HClO,因此平衡正向移动,增大了HClO的浓度,故A正确;
B.四种溶液中,水的电离程度最大的是Na2CO3,其次才是NaClO,故B错误;
C.酸性H2SO3>H2CO3>HClO>HCO3-,常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最小的是H2SO3,最大的是HClO,故C正确;
D.酸性H2SO3>H2CO3>HClO>HCO3-,因此结合H+能力最强的是CO32-,故D错误;
故答案为:BD;
(5)由2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑和Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl,可得关系式NaCl~HCl,
设最少需要消耗食盐的质量为x,则
NaCl~HCl
58.5 36.5
x 100t×36.5%
$\frac{58.5}{36.5}=\frac{x}{100t×36.5%}$
x=58.5t,
故答案为:58.5;
(6)由图2可知反应物有FeTiO3、Cl2、C,产物是FeCl3、TiCl4、CO,钛铁矿经氯化法得到四氯化钛的化学方程式为2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO,
故答案为:2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO;
(7)镁还原TiCl4的反应条件是在高温条件下进行的,高温下3Mg+N2$\frac{\underline{\;高温\;}}{\;}$Mg3N2,因此不能选择氮气而选择氩气,
故答案为:3Mg+N2$\frac{\underline{\;高温\;}}{\;}$Mg3N2.
点评 本题考查氯碱工业为基础的化工生产,侧重于燃料电池、电解原理、盐类水解规律、氧化还原化学方程式的书写以及计算的考查,为高频考点,综合性很强,题目难度中等,掌握好化学反应原理、加强计算能力的培养是解题之道.

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案| 操作及现象 | 结论 | |
| A | 向PbSO4悬浊液中加入KI溶液时出现黄色沉淀 | Ksp(PbI2)<Ksp(PbSO4) |
| B | 向某溶液中滴加氯水后再加入稀C6H5OH溶液,溶液呈红色 | 原溶液中可能含有Fe2+ |
| C | 向Na2SiO3溶液中通入过量SO2气体 | 反应为:SiO${\;}_{3}^{2-}$+SO2+H2O=H2SiO3↓+SO${\;}_{3}^{2-}$ |
| D | 将氢气还原氧化铜所得的红色固体加入足量稀硝酸中,溶液变为蓝色 | 反应为:3Cu+2NO${\;}_{3}^{-}$+8H+=3Cu2++2NO↑+4H2O |
| A. | A | B. | B | C. | C | D. | D |

相关离子生成氢氧化物的pH和相关物质的溶解性如表:
| 金属离子 | 开始沉淀时的pH | 沉淀完全时的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
| 物质 | 20℃时溶解性(H2O) |
| CaSO4 | 微溶 |
| NiF | 可溶 |
| CaF | 难溶 |
| NiCO3 | Ksp=1.0×10-6 |

(2)将含镍原料粉碎的目的是提高镍的浸出率
(3)调节pH步骤中,溶液pH的调节范围是5.0≤pH<6.7.
(4)滤渣1和滤渣3主要成分的化学式分别是SiO2、CaSO4、CaF2.
(5)写出氧化步骤中加入H2O2发生反应的离子方程式2Fe2++H2O2+2H+═2Fe3++2H2O.
(6)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体.写出该反应的化学方程式:NiS+H2SO4+2HNO3═NiSO4+SO2↑+2NO↑+2H2O.
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图2.酸浸的最佳温度与时间分别为70℃、120min.
(8)沉镍过程中,若c(Ni2+)=2.0mol•L-1,欲使100mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol•L-1],则需要加入Na2CO3固体的质量最少为31.8g.(保留小数点后1位有效数字).
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 稀HNO3中加入过量的Fe 粉,充分反应后,滴入KSCN 溶液 | 溶液呈红色 | 稀HNO3将Fe 氧化为Fe3+ |
| B | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | Al 箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密了氧化膜 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 在50g质量分数为46%的乙醇水溶液中,含有氢原子数为3NA | |
| B. | 80℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | lmol有机物CH3-CH=CH-CH2-CH3中最多有9NA个原子在同一平面上 | |
| D. | l04g苯乙烯(C6H5-CH=CH2)中含有8NA的碳氢键和4NA的碳碳双键 |
| A. | CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(l)△H<-867.0 KJ•mol-1 | |
| B. | 若增加甲烷的用量,平衡后体系中CO2的百分含量不一定升高 | |
| C. | 使用催化剂,可以降低反应的活化能,减少反应所放出的热量 | |
| D. | 标准状况下4.48 L CH4参加反应,转移电子数为1.6 NA |
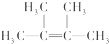 名称为2,3-二甲基-2-丁烯.
名称为2,3-二甲基-2-丁烯. .
. .
.
 ,
, 五种短周期元素X、Y、Z、W、Q的原子序数依次增.X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912.回答下列问题:
五种短周期元素X、Y、Z、W、Q的原子序数依次增.X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912.回答下列问题: