题目内容
17.醋酸镍[(CH3COO)2Ni]是一种重要的化工原料.一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料制取醋酸镍的工艺流程图如图1:
相关离子生成氢氧化物的pH和相关物质的溶解性如表:
| 金属离子 | 开始沉淀时的pH | 沉淀完全时的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
| 物质 | 20℃时溶解性(H2O) |
| CaSO4 | 微溶 |
| NiF | 可溶 |
| CaF | 难溶 |
| NiCO3 | Ksp=1.0×10-6 |

(2)将含镍原料粉碎的目的是提高镍的浸出率
(3)调节pH步骤中,溶液pH的调节范围是5.0≤pH<6.7.
(4)滤渣1和滤渣3主要成分的化学式分别是SiO2、CaSO4、CaF2.
(5)写出氧化步骤中加入H2O2发生反应的离子方程式2Fe2++H2O2+2H+═2Fe3++2H2O.
(6)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体.写出该反应的化学方程式:NiS+H2SO4+2HNO3═NiSO4+SO2↑+2NO↑+2H2O.
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图2.酸浸的最佳温度与时间分别为70℃、120min.
(8)沉镍过程中,若c(Ni2+)=2.0mol•L-1,欲使100mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol•L-1],则需要加入Na2CO3固体的质量最少为31.8g.(保留小数点后1位有效数字).
分析 含镍废料(含 NiS、Al2O3、FeO、CaO、SiO2)粉碎,加硫酸和硝酸酸浸,过滤,滤渣1为二氧化硅和硫酸钙,浸出液含有Ni2+、Fe2+、Al3+、Ca2+,加H2O2把亚铁离子氧化为Fe3+,然后加NaOH调节pH,使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,所以调节pH的范围5.0≤pH<6.7,过滤,滤渣2为氢氧化铁和氢氧化铝,滤液中含有Ni2+、Ca2+,再加氟化铵,生成CaF2沉淀,过滤,滤渣3为CaF2,滤液中加碳酸钠生成NiCO3沉淀,过滤,滤渣中加醋酸溶解,生成(CH3COO)2Ni溶液,然后蒸发浓缩、冷却结晶得到(CH3COO)2Ni固体,据此分析解答.
解答 解:(1)NH4F为离子化合物,电子式为: ;
;
故答案为: ;
;
(2)将含镍原料粉碎可以提高镍的浸出率;
故答案为:提高镍的浸出率;
(3)调节pH使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,根据表中的数据可知,调节pH的范围为5.0≤pH<6.7;
故答案为:5.0≤pH<6.7;
(4)由流程分析可知,滤渣1为二氧化硅和硫酸钙,滤渣3为CaF2;
故答案为:SiO2、CaSO4;CaF2;
(5)溶液中的亚铁离子不容易转化为沉淀,加H2O2把亚铁离子氧化为Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(6)酸浸过程中,1mol NiS被硝酸氧化失去6NA个电子,同时生成两种无色有毒气体,则生成NO和SO2,其反应的化学方程式为:NiS+H2SO4+2HNO3═NiSO4+SO2↑+2NO↑+2H2O;
故答案为:NiS+H2SO4+2HNO3═NiSO4+SO2↑+2NO↑+2H2O;
(7)由图象可知,为70℃、120min时,酸浸出率最高;
故答案为:70;120;
(8)已知NiCO3的Ksp=1.0×10-6,使100ml该滤液中的Ni2+沉淀物完全,即[c(Ni2+)≤10-5mol•L-1],
则溶液中c(CO32-)=$\frac{Ksp}{c(N{i}^{2+})}$=$\frac{1.0×1{0}^{-6}}{1{0}^{-5}}$mol/L=0.1mol/L,与Ni2+反应的n(CO32-)=cV=2mol/L×0.1L=0.2mol,
则加入的碳酸钠的总物质的量n(CO32-)=0.2mol+0.11mol/L×0.1L=0.3mol,
所以m=nM=0.3mol×106g/mol=31.8g;
故答案为:31.8.
点评 本题考查了物质分离提纯基本操作和综合应用、溶度积常数的有关计算,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握常见物质或离子的性质应用.

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案 有机物X可作为合成青蒿素的一种基本原料,已知X的结构如图,下列有关X的说法正确的是( )
有机物X可作为合成青蒿素的一种基本原料,已知X的结构如图,下列有关X的说法正确的是( )| A. | X为烃的含氧衍生物 | |
| B. | 1molX最多可以和3mol H2发生加成反应 | |
| C. | X只能发生取代反应和加成反应 | |
| D. | X可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同 |
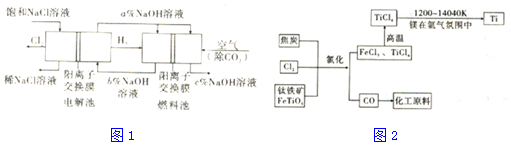
(1)电解饱和食盐水的化学方程式为2Cl-+2H2$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑.
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,正确的操作步骤的顺序是B (填序号).
①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
A.①④①②⑤③B.①②⑤④①③C.①②④⑤③D.④②⑤
(3)图中NaOII溶液的质量分数a%、b%、c%,由大到小的顺序为c%>a%>b%.
(4)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐.已知常温下,浓度均为0.1mol/L的四种钠盐溶液pH如表,下列说法不正确的是BD(填序号).
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是HClO
D.四种盐的阴离子结合H+能力最强的是HCO3-
(5)若利用电解氯化钠溶液所得的气体制36.5%的浓盐酸100t,最少需要消耗食盐58.5t.
(6)氯碱工业产品Cl2可用于冶炼钛铁矿得到金属钛,流程如图2.写出钛铁矿经氯化法得到四氯化钛的化学方程式:2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO.
(7)氮气和氩气是两种化学性质相对稳定的气体.镁还原TiCl4的反应中为防止Mg和Ti被氧化选择稀有气体氩气.试用化学反应方程式解释不选用氮气的原因:3Mg+N2$\frac{\underline{\;高温\;}}{\;}$Mg3N2.
| A. | CO2在常温下是气体,SiO2在常温下是固体 | |
| B. | C、Si、Ge的最外层电子数都是4,次外层电子数都是8 | |
| C. | CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应 | |
| D. | 该族元素的主要化合价是+4和+2 |

| A. | 氢氧化钾与硫酸的反应 | |
| B. | 金属镁与盐酸的反应 | |
| C. | 高温条件下碳粉与二氧化碳的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl固体的反应 |
| A. | 1 L 0.1 mol/L NH4NO3溶液中含有铵根离子数目为0.1NA | |
| B. | 标准状况下,22.4 L SO3中含有的氧原子数为3NA | |
| C. | 标准状况下,22.4L氯气与含有1 mol FeI2的溶液反应时,转移的电子数为2NA | |
| D. | 常温常压下,16g O2作氧化剂时转移电子数一定为2NA |
| M | N | ||
| X | Y | Z |
| A. | 最简单氢化物的稳定性:M>N>Z | B. | 最高价含氧酸的酸性:Z>M>Y | ||
| C. | 单质的熔点:X>Z>N | D. | 简单离子的半径:Z>N>X |
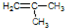 .
. .
. 的系统命名是2,6-二甲基辛烷.
的系统命名是2,6-二甲基辛烷.
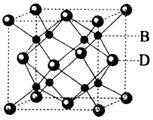 有A、B、C、D、E五种元素,其中A元素的一种核素没有中子,B元素的电负性最大,C元素的基态原子L层上有三个未成对电子,D元素为主族元素且与E元素同周期,其最外电子层上只有两个运动状态不同的电子,E元素有两种常见氧化物E2O、EO,其中E2O为砖红色.请回答:
有A、B、C、D、E五种元素,其中A元素的一种核素没有中子,B元素的电负性最大,C元素的基态原子L层上有三个未成对电子,D元素为主族元素且与E元素同周期,其最外电子层上只有两个运动状态不同的电子,E元素有两种常见氧化物E2O、EO,其中E2O为砖红色.请回答: