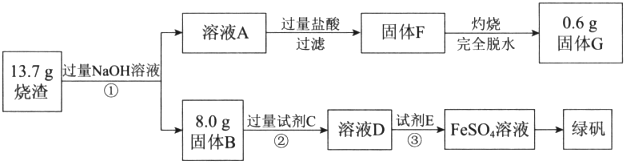
题目内容
11.硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2MgO•B2O3•H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如图:
已知:i.Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4.
ⅱ.H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g.
(1)为了提高硼镁矿粉的浸出率,可采取的措施有加热、搅拌、粉碎矿石或提高硫酸浓度等(至少答两条).
(2)“浸出液”显酸性,含H3BO3和Mg2+、SO42-,还含有Fe3+、Fe2+、Ca2+、Al3+等杂质.“除杂”时向浸出液中依次加入适量H2O2和MgO,H2O2的作用是H2O2+2H++2Fe2+=2Fe3++2H2O (用离子方程式表示),MgO除去的杂质离子是Fe3+、Al3+.
(3)已知H3BO3与过量的NaOH反应生成Na[B(OH)4],试写出H3BO3在溶液中的电离方程式H3BO3(aq)+H2O(l)?[B(OH)4]-(aq)+H+(aq).
(4)“浸取”后,采用“热过滤”的目的是防止温度下降时H3BO3从溶液中析出影响产量,母液中的主要溶质有H3BO3、MgSO4.
(5)测定所得产品的纯度:取a g硼酸,小心加热使其分解脱去水分(杂质受热不分解),得残留固体b g,则产品的纯度为$\frac{62(a-b)}{27a}$×100%.
分析 硼镁矿(2MgO•B2O3•H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸,由流程可知,加硫酸溶解只有SiO2不溶,CaO转化为微溶于水的CaSO4,趁热过滤,防止H3BO3从溶液中析出,“除杂”需先加H2O2溶液,将亚铁离子转化为铁离子,再加入MgO调节溶液的pH约为5.2,使铁离子、铝离子均转化为沉淀,则滤渣为氢氧化铝、氢氧化铁,然后蒸发浓缩、冷却结晶、过滤分离出H3BO3,母液中主要含有硫酸镁和硼酸,
(1)矿石颗粒大小影响反应速率,温度升高反应加快,搅拌也可以提高浸取率;
(2)加适量H2O2把Fe2+氧化为Fe3+,加MgO调节PH,使Fe3+、Al3+转化为沉淀而除去,所以除去的离子有Fe3+、Fe2+、Al3+;
(3)H3BO3与过量NaOH溶液反应生成Na[B(OH)4],H3BO3属于一元酸,电离出[B(OH)4]-与H+;
(4)由目信息可知:H3BO3的溶解度随温度的升高而增大,所以要采用“热过滤”,以防温度下降时H3BO3从溶液中析出;
(5)取a g硼酸,小心加热使其分解脱去水分(杂质受热不分解),得残留固体b g,反应为:2H3BO3=B2O3+3H2O,结合反应前后质量变化计算硼酸质量得到纯度.
解答 解:由流程可知,加硫酸溶解只有SiO2不溶,CaO转化为微溶于水的CaSO4,趁热过滤,防止H3BO3从溶液中析出,“除杂”需先加H2O2溶液,将亚铁离子转化为铁离子,再加入MgO调节溶液的pH约为5.2,使铁离子、铝离子均转化为沉淀,则滤渣为氢氧化铝、氢氧化铁,然后蒸发浓缩、冷却结晶、过滤分离出H3BO3,
(1)通过粉碎矿石或者升高温度或者进行搅拌或适当提高硫酸浓度都可以提高浸取率,
故答案为:加热、搅拌、粉碎矿石或提高硫酸浓度等;
(2)加适量H2O2把Fe2+氧化为Fe3+,所以H2O2的作用是:H2O2+2H++2Fe2+=2Fe3++2H2O,加MgO调节PH,使Fe3+、Al3+转化为沉淀而除去,所以除去的离子有Fe3+、Fe2+、Al3+;
故答案为:H2O2+2H++2Fe2+=2Fe3++2H2O;Fe3+、Al3+;
(3)H3BO3与过量NaOH溶液反应生成Na[B(OH)4],H3BO3属于一元酸,电离出[B(OH)4]-与H+,属于弱酸,电离方程式为:H3BO3(aq)+H2O(l)?[B(OH)4]-(aq)+H+(aq),
故答案为:H3BO3(aq)+H2O(l)?[B(OH)4]-(aq)+H+(aq);
(4)由题目信息可知:H3BO3的溶解度随温度的升高而增大,所以要采用“热过滤”,以防温度下降时H3BO3从溶液中析出影响产量,滤液蒸发浓缩、冷却结晶、过滤分离出H3BO3,母液中主要含有硫酸镁和硼酸,
故答案为:防止温度下降时H3BO3从溶液中析出影响产量;H3BO3、MgSO4;
(5)取a g硼酸,小心加热使其分解脱去水分(杂质受热不分解),得残留固体b g,
反应为:2H3BO3=B2O3+3H2O,△m
2×62 54
m (a-b)g
m=$\frac{2×62(a-b)}{54}$g
结合反应前后质量变化计算硼酸质量得到纯度=$\frac{2×62×(a-b)}{54a}$×100%=$\frac{62(a-b)}{27a}$×100%,
故答案为:$\frac{62(a-b)}{27a}$×100%;
点评 本题考查物质制备方案、物质的分离提纯、对操作与试剂的分析评价、化学反应速率影响因素、盐类水解、化学方程式计算等,是对学生综合能力的考查,需要学生具备扎实的基础,题目难度中等.

| A. | 32克O2所含的原子数目为2NA | |
| B. | 0.5molH2O含有的原子数目为1.5NA | |
| C. | 1molH2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是1mol |
| A. | 氨水溶解氯化银沉淀:AgCl+2NH3•H2O=[Ag(NH3)2]+Cl-+2H2O | |
| B. | 向Na2S2O3溶液中通入足量氯水:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ | |
| C. | 酸性K2Cr2O7溶液氧化双氧水:Cr2O72-+8H++5H2O2=2Cr3++4O2↑+9H2O | |
| D. | 1.0mol/L的NaAlO2溶液和2.5mol/L盐酸等体积混合:AlO2-+4H+=5Al3++2H2O |
| A. | 该反应是一个放热反应 | |
| B. | 参加反应的氢气和氧气的总能量高于反应生成的水的总能量 | |
| C. | 在该化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量 | |
| D. | 发生反应时,断开反应物中的H-H键和O-O键都要吸收能量 |
| A. | ③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |