题目内容
5.下列叙述不正确的是( )| A. | 硅酸钠溶液容易吸收空气中CO2变质而生成硅酸 | |
| B. | Fe与Cl2反应生成FeCl3,Fe与S反应生成FeS | |
| C. | 实验室盛放NaOH溶液时不能使用玻璃塞,应该用橡胶塞 | |
| D. | 加碘食盐能使淀粉溶液变蓝 |
分析 A、碳酸的酸性强于硅酸;
B、氯气的氧化性强,S单质的氧化性弱;
C、氢氧化钠能和二氧化硅反应;
D、加碘食盐中的碘为碘元素.
解答 解:A、碳酸的酸性强于硅酸,故二氧化碳能和硅酸钠反应将硅酸制出来,故A正确;
B、氯气的氧化性强,能将铁氧化为+3价,生成氯化铁,S单质的氧化性弱,只能将铁氧化为+2价,生成FeS,故B正确;
C、氢氧化钠能和二氧化硅反应生成硅酸钠,是一种粘合剂,会导致瓶塞和瓶体打不开,故应用橡胶塞,故C正确;
D、加碘食盐中的碘是碘酸钾,而不是碘单质,故不能使淀粉变蓝,故D错误.
故选D.
点评 本题考查了强酸制弱酸的反应机理、氧化性强弱对产物价态的影响等问题,难度不大,注意基础的掌握.

练习册系列答案
相关题目
15.金属能导电的原因是( )
| A. | 金属阳离子与自由电子间的作用较弱 | |
| B. | 金属在外加电场作用下可失去电子 | |
| C. | 金属阳离子在外加电场作用下可发生定向移动 | |
| D. | 自由电子在外加电场作用下可发生定向移动 |
16.现有两瓶无标签的无色溶液,分别装有Na2CO3和NaHCO3,用下列试剂或方法能将两者区分的是( )
①Ca(OH)2 ②盐酸 ③CaCl2 ④NaOH ⑤加热.
①Ca(OH)2 ②盐酸 ③CaCl2 ④NaOH ⑤加热.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②⑤ |
20.下列有关离子检验的实验结论不正确的是( )
| A. | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42- | |
| B. | 向某溶液中加入烧碱溶液,加热,用湿润红色石蕊试纸检验,石蕊试纸变蓝色,该溶液中一定含有NH4+ | |
| C. | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ | |
| D. | 向某溶液中加入硝酸酸化的硝酸银溶液,有白色沉淀生成,该溶液中一定含有Cl- |
17.下列化学用语书写不正确的是( )
| A. | 氯离子的结构示意图: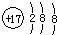 | |
| B. | 作为相对原子质量测定标准的碳核素:${\;}_6^{14}$C | |
| C. | 氯化镁的电子式: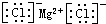 | |
| D. | 乙烯结构简式CH2=CH2 |
14.用已知物质的量浓度的NaOH溶液滴定未知物质的量浓度的盐酸,无论是酸往碱中滴还是碱往酸中滴,在其它操作正确规范的前提下,下列操作一定会使测定结果偏高的是( )
| A. | 酸式滴定管未用待测盐酸润洗 | |
| B. | 碱式滴定管未用标准碱液润洗 | |
| C. | 锥形瓶用蒸馏水洗净后未用待测液润洗 | |
| D. | 滴定前仰视读数,滴定后平视读数 |
15.ag SO2与 bg SO3所含氧原子个数相等,则a与b的比值为( )
| A. | 6:5 | B. | 2:3 | C. | 3:2 | D. | 1:1 |
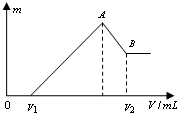 将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答: