题目内容
16.现有两瓶无标签的无色溶液,分别装有Na2CO3和NaHCO3,用下列试剂或方法能将两者区分的是( )①Ca(OH)2 ②盐酸 ③CaCl2 ④NaOH ⑤加热.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②⑤ |
分析 NaHCO3不稳定,加热易分解,与酸反应较Na2CO3剧烈,二者都能与澄清石灰水反应生成沉淀,因都含有钠元素,焰色反应都呈黄色,以此解答该题.
解答 解:①均反应生成白色沉淀,现象相同,不能鉴别,故错误;
②加入盐酸,碳酸钠先不生成气体,而碳酸氢钠马上生成气体,可鉴别,故正确;
③碳酸钠与氯化钙反应生成沉淀,而碳酸氢钠与氯化钙不反应,现象不同,可以鉴别,故正确;
④碳酸氢钠与NaOH反应生成碳酸钠和水,现象不明显,而碳酸钠与NaOH不反应,现象不能鉴别,故错误;
⑤在溶液中加热,都不分解,没有明显现象,不能鉴别,故错误;
故选C.
点评 本题考查Na2CO3和NaHCO3溶液的鉴别,为高频考点,侧重元素化合物性质的考查,注意把握性质的差异为解答的关键,注重基础知识的夯实,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.25℃时,将氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
| A. | [NH4+]=[SO42-] | B. | [NH4+]>[SO42-] | ||
| C. | [NH4+]<[SO42-] | D. | [OH-]+[SO42-]=[H+]+[NH4+] |
11.N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O:3CO+2NO2═3CO2+N2O.下列关于N2O的说法一定正确的是( )
| A. | N2O有氧化性,在该反应中是氧化产物 | |
| B. | N2O会迅速与人体血红蛋白结合,使人中毒 | |
| C. | 上述反应,每消耗2molNO2,就会生成22.4LN2O | |
| D. | 在常温常压下,46gNO2参加反应转移电子3mol |
1.在一密闭容器中有CO、H2、O2共8.5g和足量的Na2O2,用电火花引燃,使其完全反应,Na2O2增重4.9g,则原混合气体中O2的质量分数是( )
| A. | 57.6% | B. | 42.4% | C. | 53.6% | D. | 46.4% |
8.为了除去粗盐中的 Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,其中正确的操作顺序是( )
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量 Na2CO3溶液 ⑤加过量 BaCl2溶液.
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量 Na2CO3溶液 ⑤加过量 BaCl2溶液.
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ②④⑤①③ | D. | ⑤②④①③ |
5.下列叙述不正确的是( )
| A. | 硅酸钠溶液容易吸收空气中CO2变质而生成硅酸 | |
| B. | Fe与Cl2反应生成FeCl3,Fe与S反应生成FeS | |
| C. | 实验室盛放NaOH溶液时不能使用玻璃塞,应该用橡胶塞 | |
| D. | 加碘食盐能使淀粉溶液变蓝 |
6.常用补钙片的有效成分是CaCO3,某化学探究小组欲测定某补钙片中碳酸钙的含量.查阅资料得知:
一种常用的分析试剂 EDTA二钠盐(用Na2H2Y•2H2O表示)可用于测定Ca2+,其反应为:Ca2++H2Y2-═CaY2-+2H+,以铬黑T为指示剂,滴定终点溶液由红色变为蓝色.于是该实验小组做了如下实验:
步骤一:配制待测溶液.取适量补钙片研碎后,准确称取0.400g配成250mL溶液.
步骤二:滴定.用移液管取待测液25.00mL于锥形瓶中,加入适量NaOH溶液,摇匀,再加入铬黑T指示剂3滴,用0.0100mol•L-1 EDTA二钠盐溶液滴定至终点.三次重复滴定平均消耗EDTA二钠盐溶液22.50mL.
请回答下列问题:
(1)步骤一中补钙剂要用2mol/L的盐酸溶解,反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,配制待测溶液所必需的仪器除研钵、药匙、分析天平、称量瓶、烧杯、玻璃棒外,还有250mL容量瓶、胶头滴管,操作的先后顺序为:e→b→a→d→f→g→h→c(填下列操作的序号).
A.盐酸溶解 b.称量 c.定容摇匀 d.加蒸馏水稀释 e.研磨
f.用NaOH溶液调节溶液pH至7 g.转移溶液 h.洗涤并转移
(2)实验测得补钙片中CaCO3的含量为56.3%.
(3)下列操作会导致测定结果偏高的是CDE(填下列选项的字母序号).
A.未将洗涤烧杯内壁的溶液转入容量瓶
B.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
C.定容时俯视刻度线
D.滴定管下端尖嘴中有气泡存在,滴定后气泡消失
E.滴定管用蒸馏水洗净后未用标准液润洗.
| 浓度/mol•L-1 时间/min | c(CO) | c(H2) | c(CH3OH) |
| 0 | 1.0 | 2.0 | 0 |
| 2 | 0.8 | 0.2 | |
| 4 | 1.0 | 0.5 | |
| 6 | 1.0 | 0.5 |
步骤一:配制待测溶液.取适量补钙片研碎后,准确称取0.400g配成250mL溶液.
步骤二:滴定.用移液管取待测液25.00mL于锥形瓶中,加入适量NaOH溶液,摇匀,再加入铬黑T指示剂3滴,用0.0100mol•L-1 EDTA二钠盐溶液滴定至终点.三次重复滴定平均消耗EDTA二钠盐溶液22.50mL.
请回答下列问题:
(1)步骤一中补钙剂要用2mol/L的盐酸溶解,反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,配制待测溶液所必需的仪器除研钵、药匙、分析天平、称量瓶、烧杯、玻璃棒外,还有250mL容量瓶、胶头滴管,操作的先后顺序为:e→b→a→d→f→g→h→c(填下列操作的序号).
A.盐酸溶解 b.称量 c.定容摇匀 d.加蒸馏水稀释 e.研磨
f.用NaOH溶液调节溶液pH至7 g.转移溶液 h.洗涤并转移
(2)实验测得补钙片中CaCO3的含量为56.3%.
(3)下列操作会导致测定结果偏高的是CDE(填下列选项的字母序号).
A.未将洗涤烧杯内壁的溶液转入容量瓶
B.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
C.定容时俯视刻度线
D.滴定管下端尖嘴中有气泡存在,滴定后气泡消失
E.滴定管用蒸馏水洗净后未用标准液润洗.
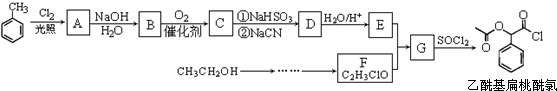
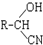 ,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′
,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′ ,E中含氧官能团的名称醇羟基和羧基.
,E中含氧官能团的名称醇羟基和羧基.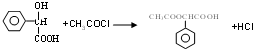 .
.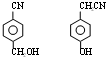 .
.