题目内容
在AgNO3、Cu(NO3)2和Zn(NO3)2混合溶液中,加入一定量的铁粉,充分反应后过滤,在滤渣中加入稀盐酸,有气体产生.则下列结论正确的是( )
| A、滤液中一定有Fe(NO3)3 |
| B、滤渣只含Ag和Cu,一定无Zn |
| C、滤渣中一定有Ag、Cu和Fe,一定无Zn |
| D、滤渣中可能有Ag、Cu、Fe和Zn |
考点:常见金属的活动性顺序及其应用
专题:元素及其化合物
分析:充分反应后过滤,在滤渣中加入稀盐酸,有气体产生,说明滤渣中含有Fe单质,Fe能和Ag+、Cu 2+发生置换反应,则溶液中一定不含Ag+、Cu 2+,锌离子和Fe不反应,所以溶液中一定含有锌离子,据此分析解答.
解答:
解:分反应后过滤,在滤渣中加入稀盐酸,有气体产生,说明滤渣中含有Fe单质,Fe能和Ag+、Cu 2+发生置换反应,则溶液中一定不含Ag+、Cu 2+,锌离子和Fe不反应,所以溶液中一定含有锌离子,
A.铁能和铁离子反应,Fe过量,所以滤液中一定没有Fe(NO3)3,故A错误;
B.因为只有Fe和HCl反应,所以滤渣中一定含有Fe,故B错误;
C.根据以上分析知,滤渣中一定有Ag、Cu和Fe,一定无Zn,故C正确;
D.根据以上分析知,滤渣中一定有Ag、Cu和Fe,一定无Zn,故D错误;
故选C.
A.铁能和铁离子反应,Fe过量,所以滤液中一定没有Fe(NO3)3,故A错误;
B.因为只有Fe和HCl反应,所以滤渣中一定含有Fe,故B错误;
C.根据以上分析知,滤渣中一定有Ag、Cu和Fe,一定无Zn,故C正确;
D.根据以上分析知,滤渣中一定有Ag、Cu和Fe,一定无Zn,故D错误;
故选C.
点评:本题考查金属的活动性强弱,明确金属之间的置换反应是解本题关键,注意盐酸性质的特殊性,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
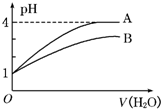 常温下pH=1的两种一元酸溶液A和B,分别加水稀释至1000倍,其pH与所加水的体积变化如图所示,则下列结论中正确的是( )
常温下pH=1的两种一元酸溶液A和B,分别加水稀释至1000倍,其pH与所加水的体积变化如图所示,则下列结论中正确的是( )| A、A酸比B酸的电离程度小 |
| B、pH=1时,B酸的物质的量浓度比A酸大 |
| C、B酸比A酸容易电离 |
| D、A是强碱,B是弱碱 |
常温下,浓度均为0.1mol?L-1的6种盐溶液pH如下,下列说法正确的是( )
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaClO |
| pH | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 | 10.3 |
| A、电离能力:HCO3->HSO3->HClO |
| B、结合H+的能力:SiO32->CO32->SO32- |
| C、6种溶液中,Na2SiO3溶液中水的电离程度最小 |
| D、若要增大新制饱和氯水中HClO的浓度,可向其中加入Na2SiO3或Na2SO3 |
下列醇类物质中,不能被氧化成醛的是( )
| A、CH3-CH2-CH2-OH |
| B、CH3-CH2-OH |
C、 |
D、 |
下列关于氯水的叙述不正确的是( )
| A、新制的氯水可使干燥的有色布条褪色 |
| B、新制的氯水呈黄绿色是因为在溶液中溶有氯气分子 |
| C、与久置氯水不同,在新制氯水中加入硝酸银溶液后无白色沉淀 |
| D、氯水久置后,会使溶液酸性增强 |
下列各组中的离子,能在溶液中大量共存的是( )
| A、Na+、H+、Cl-、CO32- |
| B、Na+、Ca2+、CO32-、NO3- |
| C、Na+、Ca2+、Cl-、NO3- |
| D、K+、H+、SO42-、OH- |
下列各组中两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A、Cu(OH)2+HCl;NaOH+HNO3 |
| B、NaHCO3+H2SO4;Na2CO3+HCl |
| C、NaHSO4+NaOH;H2SO4+NaOH |
| D、BaCl2+H2SO4;Ba(OH)2+H2SO4 |