题目内容
关于酸、碱、盐的下列各种说法中,正确的是
A.化合物电离时,生成的阳离子有氢离子的是酸
B.化合物电离时,生成的阴离子有氢氧根离子的是碱
C.化合物电离时,生成金属阳离子和酸根离子的是盐
D.NH4Cl通电时能电离出NH4+和Cl?,所以NH4Cl是盐
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.相同质量的Na、Mg、Al分别与过量的盐酸反应,在相同条件下置换出H2的体积比是( )
| A. | 1:2:3 | B. | 23:12:9 | C. | 9:12:23 | D. | 36:69:92 |
下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
A |
| N2 | NO2 | NO | HNO3 |
B | Na | Na2O2 | NaOH | NaCl | |
C | Si | SiO2 | H2SiO3 | Na2SiO3 | |
D | Al2O3 | NaAlO2 | Al | Al(OH)3 |
8. (1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.
(1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.
①检验的试剂:A.无水硫酸铜B.酸性高锰酸钾溶C.水D.氢氧化钠溶液
②除杂试剂:a.无水硫酸铜 b.乙酸 c.新制的生石灰 d.溴水
(2)如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
试回答:在右试管中通常加入饱和碳酸钠溶液.作用是:中和挥发出来的乙酸,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到乙酸乙酯;
反应中加入浓硫酸的作用是催化剂、吸水剂.
 (1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.
(1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.①检验的试剂:A.无水硫酸铜B.酸性高锰酸钾溶C.水D.氢氧化钠溶液
②除杂试剂:a.无水硫酸铜 b.乙酸 c.新制的生石灰 d.溴水
| 物质 | 检验试剂 | 除杂试剂 |
| 甲烷(乙烯) | ||
| 酒精(水) |
试回答:在右试管中通常加入饱和碳酸钠溶液.作用是:中和挥发出来的乙酸,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到乙酸乙酯;
反应中加入浓硫酸的作用是催化剂、吸水剂.



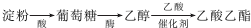
 (g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$
(g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$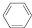 (g)+3H2(g).
(g)+3H2(g).