题目内容
在Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O,下列有关该反应说法正确的是
A.硝酸表现出了氧化性和酸性 B.还原剂与氧化剂之比为1:4
C.每个硝酸分子得到2个电子 D.硝酸铜是还原产物
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如图:

(1)由FeCl3•6H2O晶体制备无水FeCl3应采取的措施是:在通HCl气体的氛围下加热.
(2)六水合氯化铁在水中的溶解度如下:
从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入少量盐酸、加热浓缩、冷却结晶、过滤、洗涤、干燥.
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=2.6×10-9mol•L-1.(常温下Ksp[Fe(OH)3]=2.6×10-39)
(4)FeCl3的质量分数通常可用碘量法测定:称取2.300g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1000mol•L-1Na2S2O3溶液滴定用去12.50mL.
已知:I2+2S2O32-=2I-+S4O62-
①写出加入稍过量的KI溶液反应的离子方程式:2Fe3++2I-=2Fe2++I2.
②求样品中氯化铁的质量分数(写出计算过程)

(1)由FeCl3•6H2O晶体制备无水FeCl3应采取的措施是:在通HCl气体的氛围下加热.
(2)六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=2.6×10-9mol•L-1.(常温下Ksp[Fe(OH)3]=2.6×10-39)
(4)FeCl3的质量分数通常可用碘量法测定:称取2.300g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1000mol•L-1Na2S2O3溶液滴定用去12.50mL.
已知:I2+2S2O32-=2I-+S4O62-
①写出加入稍过量的KI溶液反应的离子方程式:2Fe3++2I-=2Fe2++I2.
②求样品中氯化铁的质量分数(写出计算过程)
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究——按如图装置(固定装置已略)进行实验:

(1)F装置的烧杯中发生反应的离子方程式是 ;
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 ;
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是 ;
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
实验II:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+bH2SO4 cCu2S+dCuSO4+eH2O。则a∶b= 。
cCu2S+dCuSO4+eH2O。则a∶b= 。
(6)为进一步探究该黑色物质的成分,经查阅相关文献获得下列资料。
资料1:
硫酸/mol·L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
14 | Cu 片表面无明显现象 | |
15 | 约150 | 约236 |
16 | 约140 | 约250 |
18 | 约120 | 不消失 |
资料2:X-射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的如下结论中正确是 。
A.铜与浓硫酸反应时所涉及的反应可能不止一个
B.硫酸浓度选择适当,可避免最后产物中出现黑色物质
C.该反应发生的条件之一是硫酸浓度 ≥ 15 mol/L
D.硫酸浓度越大,黑色物质越快出现、越难消失
5. 如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )
 如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 采用长玻璃导管有导气兼冷凝的作用 |
3.N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程式中正确的是( )
| A. | $\frac{1}{2}$N2H4+$\frac{1}{2}$O2═$\frac{1}{2}$N2+H2O△H=-267 kJ•mol-1 | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-133.5 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534 kJ | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534 kJ•mol-1 |


 、SO
、SO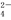 、Na+、Mg2+、Cu2+六种离子中的某几种.通过实验:
、Na+、Mg2+、Cu2+六种离子中的某几种.通过实验: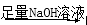 白色沉淀;
白色沉淀;