题目内容
用惰性电极电解500mLCu(NO3)2溶液一段时间后,停止电解,向所得溶液中加入0.1molCu(OH)2,恰好完全反应时,溶液浓度刚好回复至电解前.则下列说法不正确的是( )
| A、电解前电解质溶液的浓度为0.2mol/L(假设溶液体积不变) |
B、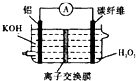 若用Al--H2O2电池(如图)为电解的电源,则理论上应消耗Al的质量为2.7g |
| C、若向电解后溶液中加入Fe和Fe2O3的混合物至恰好完全溶解,得到标况下0.896LNO气体,所得溶液中加KSCN溶液,无血色出现,则溶液的混合物中含铁元素的质量为4.48g |
| D、阳极产生O2在标况下体积为2.24L |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:加入0.1 mol Cu(OH)2,溶液浓度恢复至电解前,说明电解硝酸铜溶液后,继续电解硝酸溶液,0.1mol的Cu(OH)2相当于0.1mol的CuO和0.1mol的H2O,相当于出来0.1mol的Cu,0.1mol的H2、O2,电子转移数:0.1mol×2+0.1mol×2=0.4mol,
A.依据铜原子个数守恒,可知原溶液中含有硝酸铜物质的量为0.1mol,依据C=
计算硝酸铜的物质的量浓度;
B.若用Al--H2O2电池(如图)为电解的电源,依据串联电路特点,各个电极上转移电子数相同,计算消耗铝的质量;
C.所得溶液中加KSCN溶液,无血色出现,说明反应后溶液为硝酸亚铁溶液,依据氮原子守恒计算铁元素质量;
D.阳极为氢氧根离子放电,电极反应式为:4OH--4e-=2H2O+O2↑,依据转移电子数为0.4mol计算产生氧气的物质的量和标况下体积.
A.依据铜原子个数守恒,可知原溶液中含有硝酸铜物质的量为0.1mol,依据C=
| n |
| V |
B.若用Al--H2O2电池(如图)为电解的电源,依据串联电路特点,各个电极上转移电子数相同,计算消耗铝的质量;
C.所得溶液中加KSCN溶液,无血色出现,说明反应后溶液为硝酸亚铁溶液,依据氮原子守恒计算铁元素质量;
D.阳极为氢氧根离子放电,电极反应式为:4OH--4e-=2H2O+O2↑,依据转移电子数为0.4mol计算产生氧气的物质的量和标况下体积.
解答:
解:加入0.1 mol Cu(OH)2,溶液浓度恢复至电解前,说明电解硝酸铜溶液后,继续电解硝酸溶液,0.1mol的Cu(OH)2相当于0.1mol的CuO和0.1mol的H2O,相当于出来0.1mol的Cu,0.1mol的H2、O2,电子转移:0.1mol×2+0.1mol×2=0.4mol,
A.向所得溶液中加入0.1molCu(OH)2,溶液浓度恢复至电解前,说明溶液中含有0.1mol铜离子,所以硝酸铜的物质的量浓度为:0.1mol/0.5L=0.2mol/L,故A正确;
B.加入0.1 mol Cu(OH)2,溶液浓度恢复至电解前,说明电解硝酸铜溶液后,继续电解硝酸溶液,0.1mol的Cu(OH)2相当于0.1mol的CuO和0.1mol的H2O,相当于出来0.1mol的Cu,0.1mol的H2、O2,电子转移:0.1mol×2+0.1mol×2=0.4mol,而2.7g铝的物质的量为0.1mol,只能提供0.3mol电子,故B错误;
C.向电解后溶液中加入Fe和Fe2O3的混合物至恰好完全溶解,得到标况下0.896LNO气体,物质的量为0.04mol,原溶液中共含有0.2mol硝酸根离子,向电解后溶液中加入Fe和Fe2O3的混合物至恰好完全溶解,所得溶液中加KSCN溶液,无血色出,说明最后溶液为硝酸亚铁,依据氮原子个数守恒,可知硝酸亚铁的物质的量为(0.2mol-0.04mol)/2=0.08mol,含有二价铁离子物质的量为0.08mol,铁元素质量为0.08mol×56g/mol=4.48g,故C正确;
D.阳极为氢氧根离子放电,电解过程中共转移电子0.4mol,电极反应式为:4OH--4e-=2H2O+O2↑,所以产生氧气0.01mol,标况下气体为2.24L,故D正确;
故选:B.
A.向所得溶液中加入0.1molCu(OH)2,溶液浓度恢复至电解前,说明溶液中含有0.1mol铜离子,所以硝酸铜的物质的量浓度为:0.1mol/0.5L=0.2mol/L,故A正确;
B.加入0.1 mol Cu(OH)2,溶液浓度恢复至电解前,说明电解硝酸铜溶液后,继续电解硝酸溶液,0.1mol的Cu(OH)2相当于0.1mol的CuO和0.1mol的H2O,相当于出来0.1mol的Cu,0.1mol的H2、O2,电子转移:0.1mol×2+0.1mol×2=0.4mol,而2.7g铝的物质的量为0.1mol,只能提供0.3mol电子,故B错误;
C.向电解后溶液中加入Fe和Fe2O3的混合物至恰好完全溶解,得到标况下0.896LNO气体,物质的量为0.04mol,原溶液中共含有0.2mol硝酸根离子,向电解后溶液中加入Fe和Fe2O3的混合物至恰好完全溶解,所得溶液中加KSCN溶液,无血色出,说明最后溶液为硝酸亚铁,依据氮原子个数守恒,可知硝酸亚铁的物质的量为(0.2mol-0.04mol)/2=0.08mol,含有二价铁离子物质的量为0.08mol,铁元素质量为0.08mol×56g/mol=4.48g,故C正确;
D.阳极为氢氧根离子放电,电解过程中共转移电子0.4mol,电极反应式为:4OH--4e-=2H2O+O2↑,所以产生氧气0.01mol,标况下气体为2.24L,故D正确;
故选:B.
点评:本题考查了原电池、电解池相关知识,明确原电池、电解池工作原理是解题关键,注意各个电极电子转移数目相等,题目难度中等.

练习册系列答案
相关题目
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示.下列说法中正确的是( )
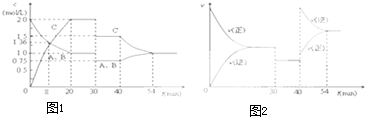

| A、第8min时 A的反应速率为0.08mol?L-1?min-1 |
| B、在0-54分钟的反应过程中该可逆反应的平衡常数始终为4 |
| C、30min时改变的条件是降低温度,40min时改变的条件是升高温度 |
| D、反应方程式中的x=1,且正反应为放热反应 |
相同状况下,20mL气体A2和10mL气体B2恰好化合生成20mL气体C,则C的化学式为( )
| A、AB |
| B、AB2 |
| C、A2B |
| D、A2B3 |
物质分类是化学研究的重要方法之一.化学工作者经常根据物质的组成对物质进行分类研究.近年来发现,在金星大气层中存在三氧化二碳.下列物质与它属于同类的是( )
| A、H2、O3 |
| B、H2SO4、H2CO3 |
| C、SO2、NO |
| D、Na2SO3、KClO3 |
A、B、C都是有机化合物,有如下转化关系:A
B
C,A的相对分子质量比B小18,B的相对分子质量比C大2,A是衡量一个国家石油化工业水平的重要标志之一的一种常见气体.以下说法正确的是( )
| +水 |
| 消去 |
| 催化氧化 |
| A、A是乙炔,B是乙醇 |
| B、A是乙烯,C是乙醛 |
| C、A是乙烯,C是乙醇 |
| D、A是环己烷,C是苯 |
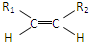
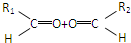
 ③-CH═CH2
③-CH═CH2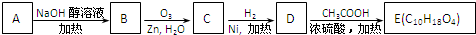
 为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O