题目内容
已知: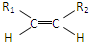
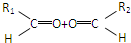
(1)该反应的生成物中含有的官能团的名称是 ,该物质在一定条件下能发生 (填序号).
①氧化反应②还原反应③酯化反应
(2)已知HCHO分子中所有原子都在同一平面内,若要使R1CHO分子中所有原子可能都在同一平面内,R1可以是 (填序号).
①-CH3 ②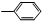 ③-CH═CH2
③-CH═CH2
(3)某氯代烃A的分子式为C6H11Cl,它可以发生如图所示转化:
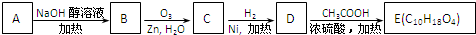
结构分析表明E分子中含有两个甲基且没有支链.
①写出下列转化的反应类型:A→B ;D→E .
②A、E的结构简式分别为 .
③写出A→B的化学方程式 .
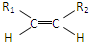
| ①O3 |
| ②Zn,H2O |
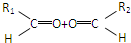
(1)该反应的生成物中含有的官能团的名称是
①氧化反应②还原反应③酯化反应
(2)已知HCHO分子中所有原子都在同一平面内,若要使R1CHO分子中所有原子可能都在同一平面内,R1可以是
①-CH3 ②
 ③-CH═CH2
③-CH═CH2(3)某氯代烃A的分子式为C6H11Cl,它可以发生如图所示转化:
结构分析表明E分子中含有两个甲基且没有支链.
①写出下列转化的反应类型:A→B
②A、E的结构简式分别为
③写出A→B的化学方程式
考点:有机物的推断
专题:有机物的化学性质及推断
分析:(1)根据结构判断官能团,推断具有的性质;
(2)根据甲烷四面体、乙烯平面构型、乙炔直线型、苯平面构型判断原子共面;
(3)C6H11Cl在氢氧化钠醇溶液加热下,发生消去反应生成烯,所以B含有碳碳双键.由信息可知C中含有碳氧双键(羰基或醛基),根据流程可知D为醇,E为二元酯,所以D为二元醇,根据酯化反应可推断D分子式为C6H14O2,E分子中含有两个甲基且没有支链,所以B为环己烯,A为一氯环己烷,即 ,E分子中含两个甲基且没有支链,应为
,E分子中含两个甲基且没有支链,应为 ,则D为
,则D为 ,C为己二醛,据此分析解答;
,C为己二醛,据此分析解答;
(2)根据甲烷四面体、乙烯平面构型、乙炔直线型、苯平面构型判断原子共面;
(3)C6H11Cl在氢氧化钠醇溶液加热下,发生消去反应生成烯,所以B含有碳碳双键.由信息可知C中含有碳氧双键(羰基或醛基),根据流程可知D为醇,E为二元酯,所以D为二元醇,根据酯化反应可推断D分子式为C6H14O2,E分子中含有两个甲基且没有支链,所以B为环己烯,A为一氯环己烷,即
 ,E分子中含两个甲基且没有支链,应为
,E分子中含两个甲基且没有支链,应为 ,则D为
,则D为 ,C为己二醛,据此分析解答;
,C为己二醛,据此分析解答;解答:
解:(1)根据生成物结构可知,分子中含有 ,为醛基,醛基可与氢气发生加成发生还原反应,也可被氧化为羧酸,
,为醛基,醛基可与氢气发生加成发生还原反应,也可被氧化为羧酸,
故答案为:醛基;①②;
(2)①R1为-CH3,分子为CH3CHO,具有甲烷结构,所有原子不可能共面,故①错误;
②R1为 ,分子结构为
,分子结构为 ,苯是平面结构,HCHO也是平面结构,所以
,苯是平面结构,HCHO也是平面结构,所以 可能为平面结构,故②正确;
可能为平面结构,故②正确;
③R1为-CH═CH2,分子为CH2═CH-CHO,乙烯是平面构型,HCHO也是平面结构,所以CH2═CH-CHO,可能为平面结构,故③正确.
故选:②③;
(3)E分子中含两个甲基且没有支链,应为 ,则D为
,则D为 ,C为己二醛,则B为环己烯,A应为
,C为己二醛,则B为环己烯,A应为 ,
,
①A为 ,氢氧化钠醇溶液加热下,发生消去反应生成环己烯B,所以A→B反应类型为消去反应;由流程图可知D为HOCH2(CH2)4CH2OH,与乙酸发生酯化反应生成E,所以D→E反应类型为酯化反应,故答案为:消去反应;酯化反应;
,氢氧化钠醇溶液加热下,发生消去反应生成环己烯B,所以A→B反应类型为消去反应;由流程图可知D为HOCH2(CH2)4CH2OH,与乙酸发生酯化反应生成E,所以D→E反应类型为酯化反应,故答案为:消去反应;酯化反应;
②A为 ,由流程图可知D为HOCH2(CH2)4CH2OH,与乙酸发生酯化反应生成E,所以E结构简式为CH3COOCH2(CH2)4CH2OOCCH3,
,由流程图可知D为HOCH2(CH2)4CH2OH,与乙酸发生酯化反应生成E,所以E结构简式为CH3COOCH2(CH2)4CH2OOCCH3,
故答案为: 、CH3COOCH2(CH2)4CH2OOCCH3;
、CH3COOCH2(CH2)4CH2OOCCH3;
③A为一氯环己烷,结构简式为 ,氢氧化钠醇溶液加热下,发生消去反应生成环己烯,反应方程式为
,氢氧化钠醇溶液加热下,发生消去反应生成环己烯,反应方程式为
 +NaOH
+NaOH
 +NaCl+H2O,
+NaCl+H2O,
故答案为: +NaOH
+NaOH
 +NaCl+H2O;
+NaCl+H2O;
 ,为醛基,醛基可与氢气发生加成发生还原反应,也可被氧化为羧酸,
,为醛基,醛基可与氢气发生加成发生还原反应,也可被氧化为羧酸,故答案为:醛基;①②;
(2)①R1为-CH3,分子为CH3CHO,具有甲烷结构,所有原子不可能共面,故①错误;
②R1为
 ,分子结构为
,分子结构为 ,苯是平面结构,HCHO也是平面结构,所以
,苯是平面结构,HCHO也是平面结构,所以 可能为平面结构,故②正确;
可能为平面结构,故②正确;③R1为-CH═CH2,分子为CH2═CH-CHO,乙烯是平面构型,HCHO也是平面结构,所以CH2═CH-CHO,可能为平面结构,故③正确.
故选:②③;
(3)E分子中含两个甲基且没有支链,应为
 ,则D为
,则D为 ,C为己二醛,则B为环己烯,A应为
,C为己二醛,则B为环己烯,A应为 ,
,①A为
 ,氢氧化钠醇溶液加热下,发生消去反应生成环己烯B,所以A→B反应类型为消去反应;由流程图可知D为HOCH2(CH2)4CH2OH,与乙酸发生酯化反应生成E,所以D→E反应类型为酯化反应,故答案为:消去反应;酯化反应;
,氢氧化钠醇溶液加热下,发生消去反应生成环己烯B,所以A→B反应类型为消去反应;由流程图可知D为HOCH2(CH2)4CH2OH,与乙酸发生酯化反应生成E,所以D→E反应类型为酯化反应,故答案为:消去反应;酯化反应;②A为
 ,由流程图可知D为HOCH2(CH2)4CH2OH,与乙酸发生酯化反应生成E,所以E结构简式为CH3COOCH2(CH2)4CH2OOCCH3,
,由流程图可知D为HOCH2(CH2)4CH2OH,与乙酸发生酯化反应生成E,所以E结构简式为CH3COOCH2(CH2)4CH2OOCCH3,故答案为:
 、CH3COOCH2(CH2)4CH2OOCCH3;
、CH3COOCH2(CH2)4CH2OOCCH3;③A为一氯环己烷,结构简式为
 ,氢氧化钠醇溶液加热下,发生消去反应生成环己烯,反应方程式为
,氢氧化钠醇溶液加热下,发生消去反应生成环己烯,反应方程式为 +NaOH
+NaOH| 醇 |
| △ |
 +NaCl+H2O,
+NaCl+H2O,故答案为:
 +NaOH
+NaOH| 醇 |
| △ |
 +NaCl+H2O;
+NaCl+H2O;
点评:本题考查有机物的结构性质、有机信息合成、限制条件同分异构体书写,难度中等,有机信息合成关键清楚烯断键生成物判断.

练习册系列答案
相关题目
 水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图.下列关于水的说法正确的是( )
水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图.下列关于水的说法正确的是( )| A、水是弱电解质 |
| B、可燃冰是可以燃烧的水 |
| C、氢氧两种元素只能组成水 |
| D、水分子间存在氢键,所以水分子很稳定 |
下列说法中正确的是( )
| A、O2的摩尔质量是16g |
| B、碱性氧化物一定是金属氧化物,酸性氧化物一定是非金属氧化物 |
| C、碳酸钠溶液能使酚酞试液变红,因此它是碱 |
| D、虽然二氧化碳溶于水能导电,但它是非电解质 |
用惰性电极电解500mLCu(NO3)2溶液一段时间后,停止电解,向所得溶液中加入0.1molCu(OH)2,恰好完全反应时,溶液浓度刚好回复至电解前.则下列说法不正确的是( )
| A、电解前电解质溶液的浓度为0.2mol/L(假设溶液体积不变) |
B、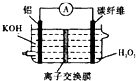 若用Al--H2O2电池(如图)为电解的电源,则理论上应消耗Al的质量为2.7g |
| C、若向电解后溶液中加入Fe和Fe2O3的混合物至恰好完全溶解,得到标况下0.896LNO气体,所得溶液中加KSCN溶液,无血色出现,则溶液的混合物中含铁元素的质量为4.48g |
| D、阳极产生O2在标况下体积为2.24L |
仅用下表提供的仪器(夹持仪器和试剂任选)不能达到相应实验目的是( )
| A、用盐酸除去BaSO4中混有的少量BaCO3 漏斗,烧杯、玻璃棒、胶头滴管、滤纸 |
| B、从食盐水中获得NaCl晶体酒精灯、玻璃棒、坩埚、泥三角 |
| C、用0.l0mol?L-1的盐酸测定未知浓度的NaOH溶液 碱式滴定管、酸式滴定管、锥形瓶、烧杯 |
| D、用溴水和CCl4除去NaBr溶液中少量NaI 烧杯、玻璃棒、胶头滴管、分液漏斗 |
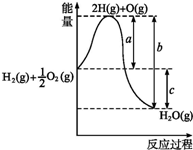 (1)已知:H2(g)+1/2O2(g)═H2O(g),反应过程中能量变化如图所示,则:
(1)已知:H2(g)+1/2O2(g)═H2O(g),反应过程中能量变化如图所示,则:

