题目内容
相同状况下,20mL气体A2和10mL气体B2恰好化合生成20mL气体C,则C的化学式为( )
| A、AB |
| B、AB2 |
| C、A2B |
| D、A2B3 |
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:相同条件下,气体摩尔体积相等,同一反应中参加反应的各气体的体积之比等于其计量数之比,再结合原子守恒确定产物化学式.
解答:
解:相同条件下,气体摩尔体积相等,同一反应中参加反应的各气体的体积之比等于其计量数之比,所以该反应中A2、B2、C的计量数之比=20mL:10mL:20mL=2:1:2,该反应方程式为2A2+B2=2C,再结合原子守恒确定产物化学式为A2B,故选C.
点评:本题考查阿伏伽德罗定律推论及质量守恒定律,明确同一反应中计量数之比与各气体体积之比的关系是解本题关键,熟练掌握阿伏伽德罗定律及其推论并灵活运用,题目难度不大.

练习册系列答案
 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
近两年来,“雾霾”一直是人们所关注的对象,如图为雾霾的主要成分示意图.下列说法不正确的是( )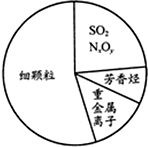

| A、苯是最简单的芳香烃 |
| B、重金属离子可导致蛋白质变性 |
| C、SO2和NxOy均属于酸性氧化物 |
| D、大量燃烧化石燃料是造成雾霾天气的一种重要因素 |
在如图分子中,处于同一平面上的原子数最多可能有( )


| A、12个 | B、14个 |
| C、18个 | D、20个 |
第3周期元素形成的单质中,属于原子晶体的是( )
| A、金刚砂 | B、金刚石 |
| C、单晶硅 | D、二氧化碳 |
 水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图.下列关于水的说法正确的是( )
水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图.下列关于水的说法正确的是( )| A、水是弱电解质 |
| B、可燃冰是可以燃烧的水 |
| C、氢氧两种元素只能组成水 |
| D、水分子间存在氢键,所以水分子很稳定 |
下列溶液中Cl-浓度最小的是( )
| A、200mL 2mol/L MgCl2溶液 |
| B、1000mL 2.5mol/L NaCl溶液 |
| C、300mL 5mol/L KCl溶液 |
| D、250mL 1mol/L AlCl3溶液 |
用惰性电极电解500mLCu(NO3)2溶液一段时间后,停止电解,向所得溶液中加入0.1molCu(OH)2,恰好完全反应时,溶液浓度刚好回复至电解前.则下列说法不正确的是( )
| A、电解前电解质溶液的浓度为0.2mol/L(假设溶液体积不变) |
B、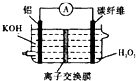 若用Al--H2O2电池(如图)为电解的电源,则理论上应消耗Al的质量为2.7g |
| C、若向电解后溶液中加入Fe和Fe2O3的混合物至恰好完全溶解,得到标况下0.896LNO气体,所得溶液中加KSCN溶液,无血色出现,则溶液的混合物中含铁元素的质量为4.48g |
| D、阳极产生O2在标况下体积为2.24L |
将一定量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:
Ag2SO4(s)?Ag2O(s)+SO3(g) 2SO3(g)?2SO2(g)+O2(g)
经10分钟反应达到平衡,此时c(SO3)=0.4mol/L,c(O2)=0.05mol/L,下列叙述不正确的是( )
Ag2SO4(s)?Ag2O(s)+SO3(g) 2SO3(g)?2SO2(g)+O2(g)
经10分钟反应达到平衡,此时c(SO3)=0.4mol/L,c(O2)=0.05mol/L,下列叙述不正确的是( )
| A、SO3的分解率为20% |
| B、10分钟内ν(SO2)=0.01mol/(L?min) |
| C、容器内气体的密度为40g/L |
| D、加压,容器内固体的质量不变 |