题目内容
2.下列关于钠的化合物的说法正确的是( )| A. | 等物质的量NaHCO3、Na2CO3分别与同浓度盐酸完全反应,消耗的盐酸体积Na2CO3是NaHCO3的二倍 | |
| B. | Na2O2和Na2O均可以和盐酸反应生成相应的盐,都属于碱性氧化物 | |
| C. | 将澄清石灰水分别加入NaHCO3和Na2CO3两种盐溶液中,只有Na2CO3溶液产生沉淀 | |
| D. | Na2O2和Na2O中Na2O更稳当,Na2O2在一定条件下可以转化为Na2O |
分析 A.依据方程式:Na2CO3+2HCl=2NaCl+CO2↑+H2O; NaHCO3+HCl=NaCl+CO2↑+H2O解答;
B.碱性氧化物与水反应只生成碱;
C.碳酸氢钠、碳酸钠与氢氧化钙反应都生成碳酸钙沉淀;
D.氧化钠与氧气加热反应生成过氧化钠.
解答 解:A.依据方程式:Na2CO3+2HCl=2NaCl+CO2↑+H2O; NaHCO3+HCl=NaCl+CO2↑+H2O,1mol碳酸钠与2mol氯化氢完全反应,1mol碳酸氢钠与1mol氯化氢反应,故A正确;
B.过氧化钠与水反应生成氢氧化钠和氧气,不符合碱性氧化物定义,不是碱性氧化物,故B错误;
C.将澄清石灰水分别加入Na2CO3和NaHCO3两种盐溶液中,都会产生沉淀,方程式式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH、2NaHCO3+Ca(OH)2═CaCO3↓+Na2CO3+2H2O,都出现白色沉淀,故C错误;
D.氧化钠与氧气加热反应生成过氧化钠,所以过氧化钠更稳当,故D错误;
故选:A.
点评 本题考查了元素化合物知识,明确氧化钠、过氧化钠、碳酸钠、碳酸氢钠的性质是解题关键,注意碱性氧化物的概念,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
13.工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量小于(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量.
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器②中反应的平衡常数k=1
(4)下列叙述正确的是a(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,化学反应速率为:v(H2O)=$\frac{4}{{Vt}_{1}}$mol/(L•min)
(5)已知:2H2 (g)+O2 (g)=2H2O (g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)﹦2CO2(g)△H=-566kJ/mol.
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6mol.若用200mL 5mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)3CO2+5OH-═2CO32-+HCO3-+2H2O.
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器②中反应的平衡常数k=1
(4)下列叙述正确的是a(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,化学反应速率为:v(H2O)=$\frac{4}{{Vt}_{1}}$mol/(L•min)
(5)已知:2H2 (g)+O2 (g)=2H2O (g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)﹦2CO2(g)△H=-566kJ/mol.
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6mol.若用200mL 5mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)3CO2+5OH-═2CO32-+HCO3-+2H2O.
10.下列各组粒子在指定溶液中一定能大量共存的一组是( )
| A. | 在KMnO4溶液中:SO42-、Mg2+、CH3CH2OH、NO3- | |
| B. | 在由水电离的氢离子浓度为1×10-12mol/L的溶液中:Fe2+、Na+、NO3-、Cl- | |
| C. | 离子浓度相同的溶液中:CH3COO-、SO42-、NH4+、Cu2+ | |
| D. | 无色溶液中:Fe3+、NO3-、Na+、Cl- |
17.下列实验设计方案中,可行的是( )
| A. | 用加入过量铁粉的方法除去Cu(NO3) 2溶液中混有的AgNO3 | |
| B. | 用NaOH溶液除去CO2中混有的HCl气体 | |
| C. | 向某无色未知溶液中加入BaCl2溶液,以检验未知溶液中是否含有SO42- | |
| D. | 用紫色石蕊试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
11.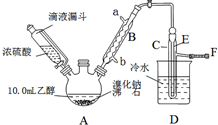 实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:
(1)A装置的名称是三颈烧瓶.
(2)实验中用滴液漏斗代替分液漏斗的优点为平衡压强,使浓硫酸顺利流下.
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O.
(4)给A加热的目的是升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动,F接橡皮管导入稀NaOH溶液,其目的主要是吸收SO2、Br2、HBr防止空气污染.
(5)图中C中的导管E的末端须在水面以下,其目的是使溴乙烷充分冷凝,提高产率.
(6)为了除去产品中的主要杂质,最好选择下列C(选填序号)溶液来洗涤所得粗产品.
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(7)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g.
①在上述提纯过程中每次分液时产品均从分液漏斗的下口(上口或下口)取得.
②从乙醇的角度考虑,本实验所得溴乙烷的产率是53.3%.
 实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(2)实验中用滴液漏斗代替分液漏斗的优点为平衡压强,使浓硫酸顺利流下.
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O.
(4)给A加热的目的是升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动,F接橡皮管导入稀NaOH溶液,其目的主要是吸收SO2、Br2、HBr防止空气污染.
(5)图中C中的导管E的末端须在水面以下,其目的是使溴乙烷充分冷凝,提高产率.
(6)为了除去产品中的主要杂质,最好选择下列C(选填序号)溶液来洗涤所得粗产品.
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(7)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g.
①在上述提纯过程中每次分液时产品均从分液漏斗的下口(上口或下口)取得.
②从乙醇的角度考虑,本实验所得溴乙烷的产率是53.3%.