题目内容
8.下列反应中的氨与反应4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O中的氨作用相同的是( )| A. | 2Na+2NH3=2NaNH2+H2↑ | B. | NH3+HCl=NH4Cl | ||
| C. | 4NH3+6NO=5N2+6H2O. | D. | 3SiH4+4NH3=Si3N4+12H2 |
分析 4NH3+5O2→4NO+6H2O反应中氨气中N元素的化合价升高,则氨气作还原剂,根据化合价的变化分析.
解答 解:反应4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O中N元素化合价升高,被氧化,氨气为还原剂,
A.2Na+2NH3→2NaNH2+H2↑反应中,NH3中N元素的化合价不变,H元素化合价降低,氨气为氧化剂,故A错误;
B.HCl+NH3═NH4Cl反应中,没有元素化合价的变化,不是氧化还原反应,故B错误;
C.反应4NH3+6NO=5N2+6H2O中N元素的化合价升高,则氨气作还原剂,故C正确;
D.3SiH4+4NH3=Si3N4+12H2反应中,只有H元素化合价发生变化,氨气中H元素化合价为+1价,SiH4中H为-1价,氨气为氧化剂,故D错误.
故选C.
点评 本题考查了氨气的性质,侧重于氧化还原反应知识应用的考查,注意根据氨气中N元素的化合价变化分析,题目难度不大.

练习册系列答案
相关题目
18.对于3Cl2+6NaOH═5NaCl+NaClO3+3H2O的反应,下列说法中不正确的是( )
| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 被氧化的氯原子个数与被还原的氯原子个数比是1:5 | |
| C. | Cl2既是氧化剂,又是还原剂 | |
| D. | 得电子的氯原子个数与失电子的氯原子个数之比为5:1 |
19.下列说法正确的是( )
| A. | 2.3 g Na投入到97.7 g水中形成的溶液溶质质量分数为2.3% | |
| B. | 25 g CuSO4•5H2O溶于75 g水之后,溶质的质量分数为16% | |
| C. | Na2O2溶于水后溶质未发生改变 | |
| D. | 6.2 g Na2O溶于水后溶质仍为6.2 g |
16.向某NaOH溶液中通人CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加人盐酸,产生的气体体积V(CO2)与加人盐酸的体积V(HCl)的关系有下列图示四种情况,且(2).(3).(4)图中分别有OA<AB,OA=AB,OA>AB,则下列分析与判断一定正确的是(不计CO2的溶解)( )


| A. | (1)图显示M中只有一种溶质且为Na2CO3 | |
| B. | (3)图显示M中有两种溶质且为Na2CO3.NaOH | |
| C. | (2)图显示M中有两种溶质且为Na2CO3.NaHCO3 | |
| D. | (4)图显示M中c(NaHCO3)=c(Na2CO3) |
13.工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量小于(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量.
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器②中反应的平衡常数k=1
(4)下列叙述正确的是a(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,化学反应速率为:v(H2O)=$\frac{4}{{Vt}_{1}}$mol/(L•min)
(5)已知:2H2 (g)+O2 (g)=2H2O (g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)﹦2CO2(g)△H=-566kJ/mol.
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6mol.若用200mL 5mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)3CO2+5OH-═2CO32-+HCO3-+2H2O.
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器②中反应的平衡常数k=1
(4)下列叙述正确的是a(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,化学反应速率为:v(H2O)=$\frac{4}{{Vt}_{1}}$mol/(L•min)
(5)已知:2H2 (g)+O2 (g)=2H2O (g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)﹦2CO2(g)△H=-566kJ/mol.
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6mol.若用200mL 5mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)3CO2+5OH-═2CO32-+HCO3-+2H2O.
20.锰丝放入稀硫酸中,有气泡产生,放入硫酸铝溶液中,表面没有金属析出.下列关于锰活动性判断不正确的是( )
| A. | Mn>Cu | B. | Al>Mn | C. | Mn>Mg | D. | Mn>H |
17.下列实验设计方案中,可行的是( )
| A. | 用加入过量铁粉的方法除去Cu(NO3) 2溶液中混有的AgNO3 | |
| B. | 用NaOH溶液除去CO2中混有的HCl气体 | |
| C. | 向某无色未知溶液中加入BaCl2溶液,以检验未知溶液中是否含有SO42- | |
| D. | 用紫色石蕊试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
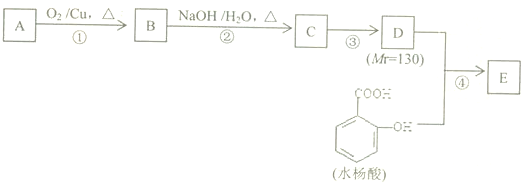
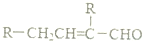
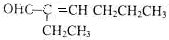 ,若要检验C中所含官能团,一次取样检验,按使用的先后顺序写出所用试剂用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键.
,若要检验C中所含官能团,一次取样检验,按使用的先后顺序写出所用试剂用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键. .
.