题目内容
10.硫是一种重要的非金属元素,在自然界中以游离态和多种化合态形式存在.其中二氧化硫是主要的大气污染物之一.完成下列填空:(1)依据平衡移动原理,用化学用语解释将SO2通入CaCO3悬浊液使之变澄清的原因CaCO3(s)?Ca2+(ag)+CO32-(ag)CO32-+2SO2+H2O=CO2+2HSO3-..
(2)火法炼铜中有如下反应:
Ⅰ:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1
Ⅱ:2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJ•mol-1
①在反应Ⅱ中,只作氧化剂的是Cu2O(用化学式表示).
②反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=-217.4kJ•mol-1.
(3)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,配平下列反应式:
Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+
(4)将SO2通入氯酸溶液中生成一种强酸和一种氧化物,已知反应掉1.5mol氯酸时转移了9.03×1023个电子,写出该反应的化学方程式SO2+2HClO3=H2SO4+2ClO2.
分析 (1)碳酸钙的悬浊液中存在溶解平衡,所以而通入二氧化硫与水反应生成亚硫酸酸性比碳酸的酸性强,能够与碳酸根离子反应,消耗碳酸根离子浓度,促使沉淀溶解平衡正向移动;
(2)①所含元素化合价升高的反应物为还原剂,所含元素化合价化合价降低的反应物为氧化剂,分析反应2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)中各元素化合价变化,据此判断;
②根据盖斯定律,由已知热化学方程式乘以合适的系数进行适当的加减,反应热也乘以相应的系数进行相应的加减;
(3)反应中锰元素化合价+2价变化为+7价,电子转移5e-,S2O82-中硫元素化合价+6价反应过程中化合价不变,S2O82-中有2个O由-1价,变化为-2价,电子转移2e-,电子转移总数为10e-,Mn2+前系数,2,S2O82-,前系数为5,结合原子守恒、电荷守恒配平书写离子方程;
(4)氯酸具有氧化性,其中氯元素的化合价为+5价,根据转移的电子数来判断产物中氯元素的价态.
解答 解:(1)碳酸钙的悬浊液中存在溶解平衡,方程式:CaCO3(s)?Ca2+(ag)+CO32-(ag),通入二氧化硫与水反应生成亚硫酸酸性比碳酸的酸性强,能够与碳酸根离子反应,消耗碳酸根离子浓度,促使沉淀溶解平衡正向移动,离子方程式:CO32-+2SO2+H2O=CO2+2HSO3-;
故答案为:CaCO3(s)?Ca2+(ag)+CO32-(ag) CO32-+2SO2+H2O=CO2+2HSO3-;
(2)①2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)中,Cu2O中铜元素化合价降低,做氧化剂,Cu2S中铜元素化合价降低,硫元素化合价升高,所以Cu2O只做氧化剂,Cu2S既是氧化剂又是还原剂,
故答案为:Cu2O;
②Ⅰ2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g)△H=-768.2KJ•mol-1
②Ⅱ2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ•mol-1
根据盖斯定律,Ⅰ+Ⅱ得:3Cu2S(s)+3O2(g)=6Cu(s)+3SO2(g),故△H=$\frac{1}{3}$×(-768.2KJ•mol-1+116.0KJ•mol-1)=-217.4kJ•mol-1;
故答案为:-217.4kJ•mol-1;
(3)反应中锰元素化合价+2价变化为+7价,电子转移5e-,S2O82-中硫元素化合价+6价反应过程中化合价不变,S2O82-中有2个O由-1价,变化为-2价,电子转移2e-,电子转移总数为10e-,Mn2+前系数,2,S2O82-,前系数为5,结合原子守恒、电荷守恒配平书写离子方程式为:2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+,反应中锰元素化合价+2价变化为+7价,做还原剂被氧化生成氧化产物为MnO4-,
故答案为:2、5、8,2、10、16;
(4)氯酸具有氧化性,其中氯元素的化合价为+5价,有1.5×6.02×1023个即1.5mol电子转移时,1.5mol氯酸中氯元素的化合价应由+5价降到+4价,所以产物中氯元素以二氧化氯的形式存在,二氧化硫被氧化为硫酸,
故答案为:SO2+2HClO3=H2SO4+2ClO2.
点评 本题考查了沉淀溶解平衡移动的影响因素,反应热的计算、氧化还原反应方程式的书写,明确影响沉淀溶解平衡移动因素,熟悉盖斯定律计算反应热的方法,氧化还原反应得失电子守恒、原子个数守恒的规律是解题关键,题目难度中等.

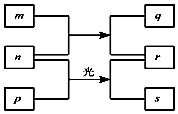 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z的单质.通常为黄绿色气体,q的水溶液具有漂白性.0.01mol/L r溶液的pH为2,p是甲烷.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z的单质.通常为黄绿色气体,q的水溶液具有漂白性.0.01mol/L r溶液的pH为2,p是甲烷.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | |
| B. | 元素的非金属性Z>X>Y | |
| C. | Y的氢化物常温常压下为气态 | |
| D. | X的最高价氧化物对应的水化物为弱酸 |
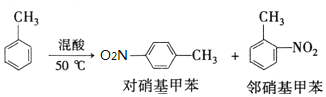
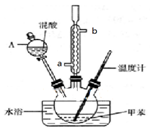 某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):
某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):反应原理:
实验中可能用到的数据:
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到纯净的一硝基甲苯共15g.
请回答下列问题:
(1)实验前需要在三颈瓶中加入少许沸石(或碎瓷片),目的是防止暴沸.
(2)冷凝管的作用是冷凝回流;冷却水从冷凝管的a(填“a”或“b”)端进入.
(3)仪器A的名称是分液漏斗,使用该仪器前必须进行的操作是检查是否漏液.
(4)分离反应后产物的方案如下:

其中,操作1的名称为分液,操作2必需的玻璃仪器有6种
(5)本实验中一硝基甲苯的产率为77.5%(已知:甲苯的分子量为92,一硝基甲苯的分子量为137,结果保留小数点后一位数字).

 向恒容密闭容器中充入2.0mol A和3.0mol B,发生反应xA(g)+2B(g)?yC(g).恒温下反应10min后突然改变某一条件,12min时达到化学平衡状态I;18min时升高温度,22min时达到化学平衡状态II.容器中A、C的物质的量浓度随时间变化的曲线如图所示,请根据题给信息回答下列问题:
向恒容密闭容器中充入2.0mol A和3.0mol B,发生反应xA(g)+2B(g)?yC(g).恒温下反应10min后突然改变某一条件,12min时达到化学平衡状态I;18min时升高温度,22min时达到化学平衡状态II.容器中A、C的物质的量浓度随时间变化的曲线如图所示,请根据题给信息回答下列问题: