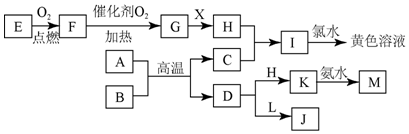
题目内容
11.将10ml0.01mol/LBaCl2溶液和10ml0.01mol/LAgNO3溶液混合,混合后溶液中Ag+的浓度为3.6×10-8mol/L.(Ksp(AgCl)=1.8×10-10)分析 BaCl2溶液和AgNO3溶液混合发生反应Ag++Cl-=AgCl↓,根据c=$\frac{n}{V}$计算混合溶液中Cl-浓度,再据Ksp(AgCl)=1.8×10-10计算Ag+的浓度.
解答 解:BaCl2溶液和AgNO3溶液混合发生反应Ag++Cl-=AgCl↓,反应后溶液中Cl-的物质的量浓度为$\frac{0.01mol/L×2×0.01L-0.01mol/L×0.01L}{0.02L}$=0.005mol/L,Ksp(AgCl)=1.8×10-10,所以Ag+的浓度为$\frac{1.8×1{0}^{-10}}{5×1{0}^{-3}}$=3.6×10-8 mol/L,
故答案为:3.6×10-8 mol/L.
点评 本题考查物质的量浓度有关计算、据沉淀的溶度积的有关计算等,比较基础,关键是根据离子方程式确定氯离子的物质的量.

练习册系列答案
相关题目
13.下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是( )
| A. | NaAlO2和HCl | B. | NaOH和NaHCO3 | C. | CO2和NaOH | D. | Na2CO3和HCl |
16.CsICl2是一种碱金属的化合物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是( )
| A. | Cs显+3价 | |
| B. | CsICl2溶于水,电离生成:Cs+、I-、Cl- | |
| C. | 酸性高锰酸钾溶液中滴加CsICl2溶液,溶液褪色 | |
| D. | 在CsICl2溶液中通入Cl2,有单质碘生成 |
3.下列说法正确的是( )
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 中和热测定实验中,若用铜质搅拌器,则所测中和热的绝对值偏大 | |
| C. | 利用油脂在碱性条件下的水解,可以制甘油和肥皂 | |
| D. | 蛋白质属于天然高分子化合物,盐酸可以使蛋白质变黄,称为颜色反应 |
1.下列反应的△H>0的是( )
| A. | Ba(OH)2?8H2O与NH4Cl的反应 | B. | 碳在氧气中燃烧的反应 | ||
| C. | 酸碱中和反应 | D. | 生石灰和水的反应 |