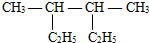题目内容
Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48L.下列推断中不正确的是( )
| A、参加反应的Mg、Al共0.2 mo1 |
| B、参加反应的HC1为0.4mol |
| C、Mg、Al在反应中共失去0.4 mol电子 |
| D、若与足量的稀硫酸反应能产生0.2molH2 |
考点:镁的化学性质,化学方程式的有关计算,铝的化学性质
专题:几种重要的金属及其化合物
分析:Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48L,n(H2)=
=0.2mol,因为酸过量,金属完全反应,反应过程中转移电子相等,根据原子守恒可以计算参加反应的HCl的物质的量,据此分析解答.
| 4.48L |
| 22.4L/mol |
解答:
解:Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48L,n(H2)=
=0.2mol,
A.因为反应后Mg、Al化合价不同,且金属混合物的质量未知,所以无法计算混合金属的物质的量,故A错误;
B.根据H原子守恒得n(HCl)=2n(H2)=0.4mol,故B正确;
C.根据转移电子相等知,Mg、Al在反应中共失去物质的量=0.2mol×2=0.4 mol,故C正确;
D.因为金属混合物不足量,且Mg、Al与稀盐酸、稀硫酸反应生成物中金属元素化合价相同,所以只要金属混合物的量不变,则与硫酸反应生成的氢气和与盐酸生成的氢气量相同,故D正确.
故选A.
| 4.48L |
| 22.4L/mol |
A.因为反应后Mg、Al化合价不同,且金属混合物的质量未知,所以无法计算混合金属的物质的量,故A错误;
B.根据H原子守恒得n(HCl)=2n(H2)=0.4mol,故B正确;
C.根据转移电子相等知,Mg、Al在反应中共失去物质的量=0.2mol×2=0.4 mol,故C正确;
D.因为金属混合物不足量,且Mg、Al与稀盐酸、稀硫酸反应生成物中金属元素化合价相同,所以只要金属混合物的量不变,则与硫酸反应生成的氢气和与盐酸生成的氢气量相同,故D正确.
故选A.
点评:本题以金属混合物为载体考查化学方程式的计算,明确元素化合价变化是解本题关键,结合原子守恒、转移电子守恒解答即可.

练习册系列答案
相关题目
 已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/molNa2O2(s)+CO2(g)=Na2CO3(s)+
| 1 |
| 2 |
根据以上热化学方程式判断,下列说法正确的是( )
| A、CO的燃烧热为566kJ/mol |
| B、如图所示可表示由CO生成CO2的反应过程和能量关系 |
| C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452kJ/mol |
| D、CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为6.02×1024(个) |
在NaHCO3溶液中,若采取措施使溶液pH增大的同时,c(CO32-)的变化情况是( )
| A、增大 | B、减小 |
| C、不变 | D、可能增大,也可能减小 |
 消毒液在我们日常生活中必不可少,请结合相关知识回答下列问题.
消毒液在我们日常生活中必不可少,请结合相关知识回答下列问题.