题目内容
 已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/molNa2O2(s)+CO2(g)=Na2CO3(s)+
| 1 |
| 2 |
根据以上热化学方程式判断,下列说法正确的是( )
| A、CO的燃烧热为566kJ/mol |
| B、如图所示可表示由CO生成CO2的反应过程和能量关系 |
| C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452kJ/mol |
| D、CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为6.02×1024(个) |
考点:有关反应热的计算,化学反应的能量变化规律
专题:
分析:A.依据燃烧热的概念分析计算判断;
B.图象中的焓变是2molCO完全燃烧反应的焓变;
C.根据热化学方程式中热量与物质的量之间的关系、物质由固态变气态吸收热量以及盖斯定律来解答;
D.根据题给热化学方程式结合对应反应放出的热量计算氧化还原反应的电子转移.
B.图象中的焓变是2molCO完全燃烧反应的焓变;
C.根据热化学方程式中热量与物质的量之间的关系、物质由固态变气态吸收热量以及盖斯定律来解答;
D.根据题给热化学方程式结合对应反应放出的热量计算氧化还原反应的电子转移.
解答:
解:A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,单位为KJ/mol,CO的燃烧热为283kJ/mol,故A错误;
B.图象中的焓变应是2molCO燃烧的反应热,图象中物质的量和焓变不统一,故B错误;
C.热化学方程式为2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452kJ/mol,CO2(s)多一步变气体吸热的过程,所以本题放出的热量就少于452kJ,即△H>-452 kJ/mol,故C正确;
D.Na2O2(s)+CO2(g)=Na2CO3(s)+
O2(g)△H-226kJ/mol,每有1molNa2O2(s)反应,转移1mol电子,放热226KJ,反应放出452kJ热量时,电子转移数为2×6.02×1024(个),故D错误;
故选C.
B.图象中的焓变应是2molCO燃烧的反应热,图象中物质的量和焓变不统一,故B错误;
C.热化学方程式为2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452kJ/mol,CO2(s)多一步变气体吸热的过程,所以本题放出的热量就少于452kJ,即△H>-452 kJ/mol,故C正确;
D.Na2O2(s)+CO2(g)=Na2CO3(s)+
| 1 |
| 2 |
故选C.
点评:本题主要考查了燃烧热的概念、单位、盖斯定律等知识,掌握燃烧热的概念应用,反应焓变的意义,盖斯定律的应用是解答关键,题目难度中等.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
将100gK2CO3和KHCO3的混合物加热至质量不再变化时,剩余固体质量为81.4g,此混合物中KHCO3的质量分数是( )
| A、24.3% | B、40% |
| C、50% | D、60% |
如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )
①X的气态氢化物与Y最高价氧化物对应的水化物能发生反应生成盐
②Y、Z的气态氢化物的水溶液均呈酸性
③Z的原子序数比Y大19
④Z所在的周期中含有32种元素.

①X的气态氢化物与Y最高价氧化物对应的水化物能发生反应生成盐
②Y、Z的气态氢化物的水溶液均呈酸性
③Z的原子序数比Y大19
④Z所在的周期中含有32种元素.
| A、只有③ | B、只有①④ |
| C、只有①②③ | D、①②③④ |
Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48L.下列推断中不正确的是( )
| A、参加反应的Mg、Al共0.2 mo1 |
| B、参加反应的HC1为0.4mol |
| C、Mg、Al在反应中共失去0.4 mol电子 |
| D、若与足量的稀硫酸反应能产生0.2molH2 |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A、电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ |
| B、氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- |
| C、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ |
| D、钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe3+ |
 在一定条件下,二氧化硫和氧气发生如下反应:
在一定条件下,二氧化硫和氧气发生如下反应: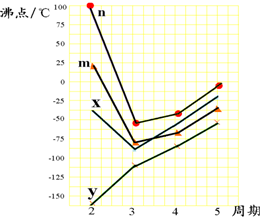 原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满.下表是主要化合价及原子半径数据:
原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满.下表是主要化合价及原子半径数据: . CH3CH=CHCH3是石油裂解的产物之一,它的键线式结构可表示为
. CH3CH=CHCH3是石油裂解的产物之一,它的键线式结构可表示为 .
. +Br2→
+Br2→ 是一种加聚产物,则其单体的结构简式为
是一种加聚产物,则其单体的结构简式为