题目内容
在NaHCO3溶液中,若采取措施使溶液pH增大的同时,c(CO32-)的变化情况是( )
| A、增大 | B、减小 |
| C、不变 | D、可能增大,也可能减小 |
考点:影响盐类水解程度的主要因素
专题:
分析:HCO3-在溶液中存在水解平衡:HCO3-+H2O?H2CO3+OH-,电离平衡,HCO3-?CO32-+H+,若采取措施使溶液pH增大,可以加碱使HCO3-数目减少,CO32-数目增加,电离平衡正向移动,也可以和过量氢氧化钙溶液反应生成碳酸钙沉淀,和氢氧化钠据此分析.
解答:
解:HCO3-在溶液中存在水解平衡:HCO3-+H2O?H2CO3+OH-,电离平衡,HCO3-?CO32-+H+,若采取措施使溶液pH增大,可以加碱溶液,OH-+H+=H2O,使HCO3-数目减少,CO32-数目增加,电离平衡正向移动,也可以和过量氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOH,溶液PH增大,碳酸根离子浓度减小;c(CO32-)的变化情况是可能增大,也可能减小.
故选D.
故选D.
点评:本题考查离子反应、水解平衡移动,题目难度不大,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
下列反应不属于消去反应的是( )
A、CH3CH2OH
| |||
B、CH3CHBrCH3+NaOH
| |||
C、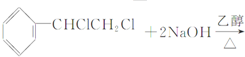  | |||
D、2CH3OH
|
Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48L.下列推断中不正确的是( )
| A、参加反应的Mg、Al共0.2 mo1 |
| B、参加反应的HC1为0.4mol |
| C、Mg、Al在反应中共失去0.4 mol电子 |
| D、若与足量的稀硫酸反应能产生0.2molH2 |
在一定温度下,将CO和H2O(g)各1mol放在密闭容器中反应,到达平衡后测得CO2为0.6mol,再通入4mol H2O(g),到达新的平衡后,CO2的物质的量( )
| A、等于0.6mol |
| B、等于1mol |
| C、0.6mol<n(CO2)<1mol |
| D、大于1mol |
分别处于第二、三周期的主族元素A和B,它们离子的电子层相差两层,已知A处于第m族,B处于第n族,A只有正化合价,则A、B原子核外的电子总数分别为( )
| A、m+2、10+n |
| B、m、n |
| C、3、7 |
| D、m-2、10-n |
