题目内容
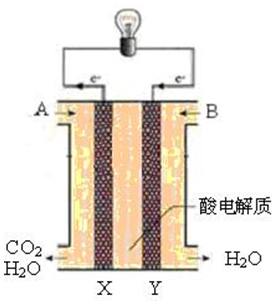
6. 如图的转化关系中,已知A是由短周期元素组成的盐,H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.
如图的转化关系中,已知A是由短周期元素组成的盐,H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.试回答下列问题:
(1)写出D(少量)、H、X反应生成A的化学方程式:NH3+SO2+H2O═NH4HSO3;
(2)写出D与K反应生成的正盐溶液中的离子浓度大小关系:c(NH4+)>c(SO42-)>c(H+)>c(OH-);
(3)一定温度下,有可逆反应:aD(g)+bY(g)?cE(g)+dX(g),在2L密闭容器中,充入4molD和5molY,有催化剂存在下,2min后反应达到平衡,测得平衡时容器内的压强比反应前增加了.则前2min内用E表示的平均反应速率为0.5mol•L-1•min-1,平衡时D的浓度为1mol•L-1.
(4)已知:2H(g)+Y(g)?2I(g)△H=-196.6kJ•mol-1.当加入4mol H和2molY后,放出345kJ的热时,H的转化率是87.5%.
分析 X为无色液体,与过氧化钠反应得到B与气体Y,则X是H2O,Y是O2,B是NaOH.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,说明H应该是SO2.SO2具有还原性,被过氧化钠氧化生成硫酸钠,硫酸钠和钡离子反应生成硫酸钡白色沉淀.SO2被氧气氧化生成三氧化硫,三氧化硫溶于水生成硫酸,即I是SO3,K是H2SO4.一个D分子中含有10个电子,经过系列反应得到强酸G,则D是NH3,则E是NO,F是NO2,所以G是HNO3.A是由短周期元素组成的酸式盐,所以A是NH4HSO3,则C是Na2SO3,以此解答该题.
解答 解:(1)D、H(过量)、X反应生成A的化学方程式为:NH3+SO2+H2O═NH4HSO3,故答案为:NH3+SO2+H2O═NH4HSO3;
(2)NH3与硫酸反应生成(NH4)2SO4,铵根离子部分水解使溶液呈酸性,故溶液中的离子浓度关系为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);
(3)一定温度下,在2L密闭容器中,充入4mol D和5mol Y,有催化剂存在下,2min后反应达到平衡,测得平衡时容器内的压强比反应前增加了$\frac{1}{18}$.依据化学平衡三段式列式计算:反应为4NH3+5O2=4NO+6H2O,设生成一氧化氮物质的量为X
有可逆反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)
起始量(mol) 4 5 0 0
变化量(mol) X $\frac{5}{4}$X X $\frac{6}{4}$X
平衡量(mol) 4-X 5-$\frac{5}{4}$X X $\frac{6}{4}$X
测得平衡时容器内的压强比反应前增加了$\frac{1}{18}$,相同条件下,压强之比等于物质的量之比,4-X+5-$\frac{5}{4}$X+X+$\frac{6}{4}$X=5+4+(5+4)×$\frac{1}{18}$
X=2mol,
则前2min内用E表示的平均反应速率=$\frac{\frac{2mol}{2L}}{2min}$=0.5mol/L•min;
平衡时D为NH3的浓度=$\frac{(4-2)mol}{2L}$1mol/L;
故答案为:0.5;1;
(4)2SO2(g)+O2(g)═2SO3(g);△H=-196.6kJ•mol-1,表示通常条件下2molSO2(g)与1molO2(g)反应生成2molSO3(g)放出热量196.6kJ,放出345kJ热量,参加反应的二氧化硫的物质的量为$\frac{345KJ}{196.6KJ}$×2mol=3.5mol.
所以二氧化硫的转化率为$\frac{3.5mol}{4mol}$×100%=87.5%,
故答案为:87.5%.
点评 本题考查无机物的推断,为高考常见题型,突破点为X(无色液体)与Na2O2反应生成Y(气体)和B,需要学生熟练掌握元素化合物知识,注意根据转化关系中特殊反应进行推断,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 用惰性电极电解NaCl溶液2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 铜片跟三氯化铁溶液反应:Fe3++Cu=Cu2++Fe2+ | |
| C. | 用FeSO4除去酸性废水中Cr2O72-:Cr2O72-+6Fe2++7H2O=2Cr3++6Fe3++14OH- | |
| D. | Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O |
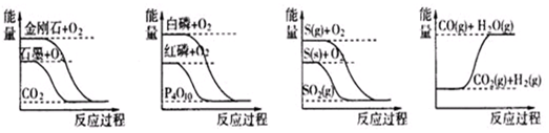
据此判断下列说法中正确的是( )
| A. | 石墨转变为金刚石是吸热反应 | |
| B. | 相同条件下,白磷比红磷稳定 | |
| C. | 相同条件下,等质量S(g)和S (s)的能量比较,S (s)能量较高 | |
| D. | CO(g)+H2O(g)=CO2(g)+H2 (g)是吸热反应 |
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | HD |
| B | 火碱 | 蔗糖溶液 | 氯化钠溶液 | NH3•H2O | 三氧化硫 |
| C | 胆矾 | 石灰水 | 硫酸钡 | Al (OH)3 | NH3 |
| D | 冰醋酸 | 福尔马林 | 苛性钾 | 碘化氢 | 乙醇 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 5.6gFe溶于1L 0.3moL/L硝酸中,转移的电子数为0.3NA | |
| B. | 冰晶体中平均每摩尔水分子最多含有2NA个氢键 | |
| C. | 12g石墨层状结构中含有平面正六边形的数目为NA | |
| D. | 1molN2和3molH2在一定条件下充分反应形成的N-H键数目为6NA |
| A. | Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3 | |
| B. | Al(OH)3、Cu(OH)2受热易分解,则Fe(OH)3受热也易分解 | |
| C. | Na可与冷水反应产生氢气,K也可与冷水反应生成氢气 | |
| D. | CO2可以使澄清的石灰水变浑浊,SO2也可以使澄清的石灰水变浑浊 |