题目内容
16.人类文明始于用火(热能的使用),现代社会的一切活动都离不开能源,很多能源与化学密切相关.仔细阅读思考后回答下列问题:(1)已知葡萄糖(C6H12O6)的燃烧热为-2804kJ/mol,25℃、101kPa条件下,葡萄糖完全燃烧的热化学方程式为C6H12O6(s)+6O2→6CO2(g)+6H2O(l),△H=-2804kJ/mol.
(2)植物光合作用原理如图

植物光合作用过程中主要的能量转化方式为光能转化为化学能,图中的光反应的方程式为6CO2+6H2O=C6H12O6+6O2.
(3)科学家根据植物光合作用原理,设计的人工光合作用工作原理如图.若光催化剂为氮化镓半导体,请写出氮化镓的化学式GaN.

(4)科学家以人工光合作用制备的CH3OH和空气为原料,设计了图所示的燃料电池,图中A处加入的物质是CH3OH.
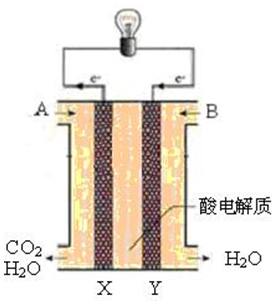
(5)铅蓄电池是最早使用的充电电池,写出其正极的电极反应式PbO2+4H++SO42-=PbSO4+2H2O;
(6)某新型铝-空气燃料电池,以铝为负极,在正极通入空气,若以NaOH溶液为电解质溶液,放电时电池负极反应为Al-3e-+4OH-=AlO2-+2H2O.
分析 (1)燃烧热是指1mol可燃物完全燃烧生成稳定氧化物放出的热量,标注物质聚集状态和对应反应的焓变写出热化学方程式;
(2)光合作用的能量转化是光能转化为化学能;光反应的物质是二氧化碳和水反应生成葡萄糖和氧气;
(3)镓是第三主族元素最外层3个电子,和氮形成的化合物中氮元素化合价-3价,据此写出化学式;
(4)原电池中电子流出的一端为负极,A处通入的为燃料;
(5)铅蓄电池中正极是二氧化铅得到电子生成硫酸铅;
(6)铝-空气燃料电池,以铝为负极,在正极通入空气,负极失铝失电子在氢氧化钠溶液中生成偏铝酸钠;
解答 解:(1)燃烧热是指1mol可燃物完全燃烧生成稳定氧化物放出的热量,标注物质聚集状态和对应反应的焓变写出热化学方程式为:C6H12O6(s)+6O2→6CO2(g)+6H2O(l),△H=-2804kJ/mol,
故答案为:C6H12O6(s)+6O2→6CO2(g)+6H2O(l),△H=-2804kJ/mol;
(2)光合作用的能量转化是光能转化为化学能;光反应的物质是二氧化碳和水反应生成葡萄糖和氧气的化学方程式为:6CO2+6H2O=C6H12O6+6O2,
故答案为:光能转化为化学能;6CO2+6H2O=C6H12O6+6O2;
(3)镓是第三主族元素最外层3个电子,和氮形成的化合物中氮元素化合价-3价,据此写出化学式为GaN,
故答案为:GaN;
(4)原电池中电子流出的一端为负极,A处通入的为燃料为甲醇,CH3OH,
故答案为:CH3OH;
(5)铅蓄电池中正极是二氧化铅得到电子生成硫酸铅,电极反应为:PbO2+4H++SO42-=PbSO4+2H2O,
故答案为:PbO2+4H++SO42-=PbSO4+2H2O;
(6)铝-空气燃料电池,以铝为负极,在正极通入空气,负极失铝失电子在氢氧化钠溶液中生成偏铝酸钠,电极反应为:Al-3e-+4OH-=AlO2-+2H2O,
故答案为:Al-3e-+4OH-=AlO2-+2H2O;
点评 本题考查了热化学方程式书写、光合作用的理解应用、原电池电极反应,注意在电解质溶液环境下的产物判断,掌握基础是解题关键,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 500mL 0.1mol/L MgCl2溶液 | B. | 100mL 0.5mol/L AlCl3溶液 | ||
| C. | 50mL1mol/L NaCl溶液 | D. | 25mL 0.5mol/L HCl溶液 |
| A. | 苯和乙烯均含有碳碳双键,均可使溴的CCl4溶液褪色 | |
| B. | 苯( )的一氯代物有一种,丙烷的一氯代物也有一种 )的一氯代物有一种,丙烷的一氯代物也有一种 | |
| C. | 乙醇和乙烯均可与酸性高锰酸钾发生反应 | |
| D. | 所有的有机物都很容易燃烧 |
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | 该装置将化学能转化为电能 | |
| B. | 电极b附近的pH值增大 | |
| C. | 电子迁移方向:电极a→灯泡→电极b→电解质溶液→电极a | |
| D. | 该电池的总反应:2H2+O2═2H2O |
| A. | 混合物 | B. | 纯净物 | C. | 酸 | D. | 碱 |
| A. | 实验证实,不存在两种邻二甲苯,所以现代物质结构理论认为苯分子中碳碳键完全相同,而不是单双键交替结构 | |
| B. | 两种有机物若具有相同的摩尔质量,不同的结构,则一定是互为同分异构体 | |
| C. | 醛能发生银镜反应,但发生银镜反应的有机物不一定是醛类 | |
| D. | 等质量的两种有机物完全燃烧生成等质量的水,则两有机物中氢元素的质量分数必须是相等 |
 如图的转化关系中,已知A是由短周期元素组成的盐,H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.
如图的转化关系中,已知A是由短周期元素组成的盐,H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子. 硫单质及其化合物在工农业生产中有着重要的应用.
硫单质及其化合物在工农业生产中有着重要的应用.

 .
. .
. .
. ),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):
),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件): .
.