题目内容
1.下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的组合正确的是( )| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | HD |
| B | 火碱 | 蔗糖溶液 | 氯化钠溶液 | NH3•H2O | 三氧化硫 |
| C | 胆矾 | 石灰水 | 硫酸钡 | Al (OH)3 | NH3 |
| D | 冰醋酸 | 福尔马林 | 苛性钾 | 碘化氢 | 乙醇 |
| A. | A | B. | B | C. | C | D. | D |
分析 由同种物质组成的为纯净物,包括单质和化合物;
由不同物质组成的为混合物;
在水溶液或熔融状态下能导电的化合物为电解质;
水溶液或熔融状态中完全电离的电解质为强电解质,水溶液中部分电离的电解质为弱电解质;
在水溶液和熔融状态下都不能导电的化合物为非电解质,
电解质和非电解质都是化合物来分析.
解答 解:A.盐酸、水煤气、硫酸、醋酸、HD分别属于混合物、混合物、强电解质、弱电解质,单质,故A错误;
B.火碱、蔗糖溶液、氯化钠、氨水、三氧化硫分别属于化合物、混合物、强电解质、混合物,非电解质,故B错误;
C.胆矾、石灰水、硫酸钡、Al (OH)3、NH3分别属于化合物、混合物、强电解质、弱电解质,非电解质,故C正确;
D.冰醋酸、福尔马林、苛性钾、碘化氢、乙醇分别属于化合物、混合物、强电解质、强电解质,非电解质,故D错误.
故选C.
点评 本题考查了纯净物、混合物、电解质、非电解质的概念判断及各种物质的成分掌握,题目难度中等.

练习册系列答案
相关题目
20.化学与科学、技术、社会、环境密切相关,下列有关说法中正确的是( )
| A. | 为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| B. | 高温条件能杀死H7N9禽流感病毒,是因为病毒的蛋白质受热变性 | |
| C. | 为消除碘缺乏症,卫生部规定必须在食盐中加单质碘 | |
| D. | 油脂是产生能量很高的营养物质,在饮食中不必控制油脂的摄入量 |
12. 双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源.利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如图所示,M、N为离子交换膜.下列说法错误的是( )
双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源.利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如图所示,M、N为离子交换膜.下列说法错误的是( )
 双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源.利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如图所示,M、N为离子交换膜.下列说法错误的是( )
双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源.利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如图所示,M、N为离子交换膜.下列说法错误的是( )| A. | 阴极室发生的反应为2H++2e-=H2↑ | |
| B. | M为阳离子交换膜,N为阴离子交换膜 | |
| C. | 若去掉双极膜(BP),阳极室会有C12生成 | |
| D. | 电路中每转移1mol电子,两极共得到0.5 mol气体 |
13.仅用一种试剂鉴别如下物质:苯、四氯化碳、碘化钠溶液、氯化钠溶液、亚硫酸钠溶液.下列试剂不能选用的是( )
| A. | 溴水 | B. | 氯化铁溶液 | ||
| C. | 酸性高锰酸钾溶液 | D. | 硝酸银溶液 |
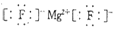 .
. 如表为元素周期表的一部分.
如表为元素周期表的一部分. 如图的转化关系中,已知A是由短周期元素组成的盐,H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.
如图的转化关系中,已知A是由短周期元素组成的盐,H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.
 硫单质及其化合物在工农业生产中有着重要的应用.
硫单质及其化合物在工农业生产中有着重要的应用.