题目内容
18.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )| A. | 5.6gFe溶于1L 0.3moL/L硝酸中,转移的电子数为0.3NA | |
| B. | 冰晶体中平均每摩尔水分子最多含有2NA个氢键 | |
| C. | 12g石墨层状结构中含有平面正六边形的数目为NA | |
| D. | 1molN2和3molH2在一定条件下充分反应形成的N-H键数目为6NA |
分析 A.求出铁和硝酸的物质的量,然后根据铁与稀硝酸反应时,当铁变为+2价时,消耗硝酸的量最少,此时3molFe~8mol硝酸来分析;
B.根据均摊法计算平均每摩尔水分子中含有得氢键数;
C.12g石墨为1molC,平均一个C为三个六面体所用,根据均摊法计算;
D.合成氨的反应为可逆反应,不能进行彻底.
解答 解:A.5.6g铁的物质的量为0.1mol,而硝酸的物质的量n=CV=0.3mol/L×1L=0.3mol,而铁与稀硝酸反应时,当铁变为+2价时,消耗硝酸的量最少,此时3molFe~8mol硝酸,故硝酸不足,铁过量,故转移的电子小于0.2NA个,故A错误;
B.冰晶胞与金刚石晶胞类似,每1个水分子形成两个氢键,所以每摩尔水分子最多含有2mol氢键,即2NA个氢键,故B正确;
C.12g石墨为$\frac{12g}{12g/mol}$=1mol,即含有NA个C,根据均摊法,一个C为三个环所用,则一个C占$\frac{1}{3}$,因此一个六元环中含有的C为$6×\frac{1}{3}=2$,则NA个C含有的六元环数目为0.5NA,故C错误;
D.合成氨的反应为可逆反应,不能进行彻底,故1mol N2和3molH2,在一定条件下充分反应,生成的氨气的物质的量小于2mol,则形成的N-H键的数目小于6NA个,故D错误.
故选B.
点评 本题考查阿伏伽德罗常数的计算,B和C为易错点和难点,考查的是晶胞知识,注意均摊法的利用.题目难度中等,是中档题.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
17.下列反应的离子方程式正确的是( )
| A. | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++HCO3-+OH-═MgCO3↓+H2O | |
| B. | 向含1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时的反应:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 向Fe(NO3)2和NaBr混合溶液中滴加少量的稀盐酸:6Br-+2NO3-+8H+=3Br2+2NO↑+4H2O |
13.仅用一种试剂鉴别如下物质:苯、四氯化碳、碘化钠溶液、氯化钠溶液、亚硫酸钠溶液.下列试剂不能选用的是( )
| A. | 溴水 | B. | 氯化铁溶液 | ||
| C. | 酸性高锰酸钾溶液 | D. | 硝酸银溶液 |
3.两种常见的非金属元素A与B,与常见的三种金属元素C、D、E,A的一种单质是自然界硬度最大的物质,B与C的单质在加热条件下反应生成淡黄色化合物X,D的单质既能与盐酸、也能与NaOH溶液反应生成H2.E的单质与水蒸气反应,生成一种黑色固体Y.请回答下列问题:
(1)X与A的稳定氧化物反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2↑.
(2)将D的单质用砂纸打磨,然后灼烧,液态的D并不滴落的原因Al熔点低,氧化铝熔点高,所以熔化的铝被氧化铝兜着,并不滴落.
(3)ag C的单质投入足量CuSO4溶液中,下列实验现象正确的有BC.
A.钠沉在溶液底部 B.熔化成银色光亮的小球
C.小球四处游动发出”嘶嘶”的声音 D.生成红色固体物质
可能的离子方程式为2Na+Cu2++2H2O=Cu(OH)2↓+2Na++H2↑.将所得沉淀过滤、洗涤、灼烧,可得到$\frac{40a}{23}$g固体.
(4)为探究黑色固体Y的成分,两探究小组分别用黑色固体Y进行以下实验.
①乙组得到的黑色粉末是FeO.
②甲组步骤1中反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O.
③乙组步骤4中,溶液变红的原因为Fe2+被氧化为Fe3+,Fe3++遇SCN-显红色;溶液褪色可能的原因是SCN-被过量Cl2氧化;验证方法为向溶液中再加入KSCN溶液,溶液呈红色,则说明之前SCN-被过量Cl2氧化.
(1)X与A的稳定氧化物反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2↑.
(2)将D的单质用砂纸打磨,然后灼烧,液态的D并不滴落的原因Al熔点低,氧化铝熔点高,所以熔化的铝被氧化铝兜着,并不滴落.
(3)ag C的单质投入足量CuSO4溶液中,下列实验现象正确的有BC.
A.钠沉在溶液底部 B.熔化成银色光亮的小球
C.小球四处游动发出”嘶嘶”的声音 D.生成红色固体物质
可能的离子方程式为2Na+Cu2++2H2O=Cu(OH)2↓+2Na++H2↑.将所得沉淀过滤、洗涤、灼烧,可得到$\frac{40a}{23}$g固体.
(4)为探究黑色固体Y的成分,两探究小组分别用黑色固体Y进行以下实验.
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色固体粉末加入稀盐酸 | 溶解,无气泡 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
②甲组步骤1中反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O.
③乙组步骤4中,溶液变红的原因为Fe2+被氧化为Fe3+,Fe3++遇SCN-显红色;溶液褪色可能的原因是SCN-被过量Cl2氧化;验证方法为向溶液中再加入KSCN溶液,溶液呈红色,则说明之前SCN-被过量Cl2氧化.
7.下列溶液和100mL 0.5mol/L CaCl2溶液所含的Cl-物质的量浓度相同的是( )
| A. | 500mL 0.1mol/L MgCl2溶液 | B. | 100mL 0.5mol/L AlCl3溶液 | ||
| C. | 50mL1mol/L NaCl溶液 | D. | 25mL 0.5mol/L HCl溶液 |
8.医用酒精是常用的消毒剂,它属于( )
| A. | 混合物 | B. | 纯净物 | C. | 酸 | D. | 碱 |
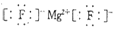 .
. 如图的转化关系中,已知A是由短周期元素组成的盐,H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.
如图的转化关系中,已知A是由短周期元素组成的盐,H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.