题目内容
10.合成氨反应的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1已知合成氨反应是一个反应物不能完全转化为生成物的反应,在某一定条件下,N2的转化率仅为10%,要想通过该反应得到92.2 kJ的热量,则在反应混合物中要投放N2的物质的量的取值范围为大于10 mol.
分析 因为该反应是可逆反应,反应物不能完全转化为生成物,该方程式表示为转化1mol氮气放出92.2kJ热量,在该条件下氮气的转化率仅为10%,则投入的氮气物质的量>$\frac{反应的氮气}{转化率}$.
解答 解:因为该反应是可逆反应,反应物不能完全转化为生成物,该方程式表示为转化1mol氮气放出92.2kJ热量,在该条件下氮气的转化率仅为10%则投入的氮气物质的量>$\frac{反应的氮气}{转化率}$=$\frac{1mol}{10%}$=10mol,
故答案为:大于10.
点评 本题考查物质的量的有关计算,为高频考点,侧重考查学生分析计算能力,明确转化率与参加反应的关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
1.运载“神舟八号”飞船的火箭燃料是偏二甲肼[(CH3)2NNH2],燃料和N2O4反应放出巨大的能量,产生大量无毒气体,把飞船送入太空.下列描述不正确的是( )
| A. | 在偏二甲肼与四氧化二氮的反应中,N2O4是氧化剂 | |
| B. | 两物质反应时,生成的无毒气体为CO2、N2、和H2O | |
| C. | 偏二甲肼中N元素的化合价均为-2价 | |
| D. | 偏二甲肼的同分异构体中,含碳碳单键的化合物只有2种 |
15.人类只有一个地球,保护环境、保护地球已成为人类共同的呼声.下列说法不正确的是( )
| A. | 日本的水俣病是由重金属镉污染引起的 | |
| B. | 垃圾处理要遵循无害化、减量化和资源化的原则 | |
| C. | 水体的富营养化是由于水体中植物营养物质过多蓄积而引起的污染 | |
| D. | 污水处理中混凝法、中和法、沉淀法、氧化还原法等都是化学方法 |
19.设NA为阿伏加德罗常数的值,下列对1mol H2O的叙述错误的是( )
| A. | 质量为18g | B. | 含有NA个氧原子 | ||
| C. | 标准状况下体积约为22.4L | D. | 含有NA个水分子 |
20.下列指定反应的离子方程式正确的是( )
| A. | Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+HClO | |
| B. | 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl- | |
| C. | NH4HCO3溶液和少量的NaOH溶液混合:HCO3-+OH-═CO32-+H2O | |
| D. | 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-=2Fe2++I2 |
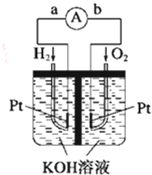 燃料电池是符合绿色化学理念的新型发电装置.如图为氢氧燃料电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
燃料电池是符合绿色化学理念的新型发电装置.如图为氢氧燃料电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答: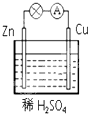 在如图所示的锌铜原电池中,Zn作原电池的负极,电极上发生的是氧化反应(填“氧化”或“还原”),该电极反应式为Zn-2e-=Zn2+,观察到的现象为锌片溶解;Cu作原电池的正 极,电极上发生的是还原反应(填“氧化”或“还原”),该电极反应式为2H++2e-=H2↑,观察到的现象为铜片上有气泡产生.
在如图所示的锌铜原电池中,Zn作原电池的负极,电极上发生的是氧化反应(填“氧化”或“还原”),该电极反应式为Zn-2e-=Zn2+,观察到的现象为锌片溶解;Cu作原电池的正 极,电极上发生的是还原反应(填“氧化”或“还原”),该电极反应式为2H++2e-=H2↑,观察到的现象为铜片上有气泡产生.