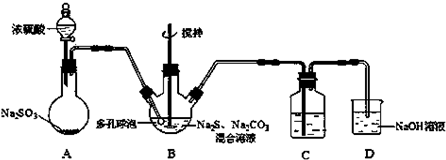
题目内容
5.某强酸性溶液X可能含有A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-中的一种或几种,取该溶液进行连续实验,实验过程如下: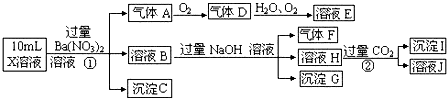
根据以上信息,回答下列问题:
①上述离子中,溶液X中除H+外还肯定含有的离子是Al3+、NH4+、Fe2+、SO42-
②请设计简单的实验检验不能确定是否含有的离子(若不止一种,可任选一种)的存在:取少量X溶液于试管中,加入几滴KSCN溶液,若溶液变红色则说明有Fe3+,反之则无Fe3+(或取少量B溶液于试管中,加入几滴AgNO3溶液,若有白色沉淀则说明有Cl-,反之则无Cl-)(或取少量X溶液于试管中,滴加Ba(NO3)2溶液至不再产生沉淀,再取上层清液于另一试管向其中滴加AgNO3溶液,若有白色沉淀则说明有Cl-,反之则无Cl-)
③写出反应①的离子方程式3Fe2++4H++NO3-=3Fe3++NO↑+2H2O、Ba2++SO42-=BaSO4↓;
④假设测定A、F、I均为0.1mol,100mL X溶液中n(H+)=0.4mol,当沉淀C物质的量大于0.7mol时,溶液X中还一定含有Fe3+.
分析 强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子;溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子;
溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子;溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此解答.
解答 解:在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,一定不含有CO32-、SO32-;
①上述离子中,溶液X中除H+外还肯定含有的离子是Al3+、NH4+、Fe2+、SO42-,故答案为:Al3+、NH4+、Fe2+、SO42-;
②不能确定是否含有的离子Fe3+和Cl-,取少量X溶液放在试管中,加入几滴KSCN,溶液变红色说明有Fe3+,反之则无Fe3+; 或者取少量B溶液放在试管中,加入几滴AgNO3溶液,白色沉淀说明有Cl-,反之则无Cl-;
故答案为:取少量X溶液于试管中,加入几滴KSCN溶液,若溶液变红色则说明有Fe3+,反之则无Fe3+(或取少量B溶液于试管中,加入几滴AgNO3溶液,若有白色沉淀则说明有Cl-,反之则无Cl-)(或取少量X溶液于试管中,滴加Ba(NO3)2溶液至不再产生沉淀,再取上层清液于另一试管向其中滴加AgNO3溶液,若有白色沉淀则说明有Cl-,反之则无Cl-);
③反应①的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O、Ba2++SO42-=BaSO4↓,
故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O、Ba2++SO42-=BaSO4↓;
④A、F、I均为0.1mol,100mLX溶液中n(H+)=0.4mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知亚铁离子为0.3mol,根据溶液电中性可知:n(H+)+2n(Fe2+)+3n(Al3+)+n(NH4+)=2n(SO42-),
n(SO42-)=$\frac{0.4+2×0.3+3×0.1+0.1}{2}$=0.7mol,当沉淀C物质的量>0.7mol时一定含有Fe3+离子,反之,含有Cl-离子,
故答案为:Fe3+.
点评 本题考查无机物的推断,为高频考点,把握离子的性质、离子之间的反应为解答的关键,侧重分析与推断能力的考查,注意沉淀及气体的判断,题目难度不大.

| A. | 日本的水俣病是由重金属镉污染引起的 | |
| B. | 垃圾处理要遵循无害化、减量化和资源化的原则 | |
| C. | 水体的富营养化是由于水体中植物营养物质过多蓄积而引起的污染 | |
| D. | 污水处理中混凝法、中和法、沉淀法、氧化还原法等都是化学方法 |
| A. | 1 mol 羟基(-OH)所含的电子总数为9NA | |
| B. | 有14g乙烯与丙烯混合气体,其含原子总数为3NA个 | |
| C. | 室温下,8g甲烷中含有共价键数为2 NA | |
| D. | 在78g苯中含3NA个碳碳双键 |
| A. | +3 | B. | +4 | C. | +5 | D. | +6 |
| A. | Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+HClO | |
| B. | 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl- | |
| C. | NH4HCO3溶液和少量的NaOH溶液混合:HCO3-+OH-═CO32-+H2O | |
| D. | 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-=2Fe2++I2 |
| 实验目的 | 试剂及方法 |
| 证明炭粉中含有CuO | |
| 鉴别MgCl2和AlCl3溶液 | |
| 分离Na2SO4和CaCO3固体混合物 | |
| 除去NaHCO3溶液中混有的Na2CO3 |
A.取样,滴加过量氢氧化钠溶液
B.向溶液中通入足量二氧化碳
C.加水溶解、过滤、结晶
D.取样,滴加稀硫酸.
| A. | 中子数为35的氯原子:${\;}_{17}^{35}$Cl | B. | 氯化铵的电子式: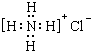 | ||
| C. | 硫化氢的结构式:H-S-H | D. | 二氧化硅的分子式:SiO2 |